
����Ŀ�������������ʣ���CCl4 ��Ag �۰�ˮ ��SO2 ��С�մ���� ��Fe(OH)3���� ��FeCl3��Һ
(1)�����������ڵ���ʵ���_____�����ڷǵ���ʵ���_____��(�����)
(2)��д��������SO2ͨ��С�մ���Һ�з�Ӧ�����ӷ���ʽ��_____��
(3)���������Һ�����Ч������������_____�����뽺�����Һ���õ�����������_____��
(4)д��ʵ�����Ʊ�NH3�Ļ�ѧ����ʽ_____��Ϊ���ռ������NH3�������ѡ��_____���������(����ĸ���)
A.Ũ���� B.��ʯ�� C.��ˮ����ͭ
���𰸡��� �٢� 2HCO3��+SO2��2CO2+SO32��+H2O �����ЧӦ ���� 2NH4C1+Ca(OH)2![]() 2NH3��+CaC12+2H2O B
2NH3��+CaC12+2H2O B
��������
��1����ˮ��Һ������״̬���ܵ���Ļ�����Ϊ����ʣ���ˮ��Һ������״̬�²�����Ļ�����Ϊ�ǵ���ʣ�
��2��SO2��̼�����Ʒ�Ӧ�����������ƺͶ�����̼��
��3�����������Һ�����Ч�����������Ƕ����ЧӦ�����뽺�����Һ���õ�����������������
��4��ʵ�������Ȼ�茶�����������ƾ��������Ʊ������������Ǽ������壬ѡ����Ը�������
��1����CCl4������״̬��ˮ��Һ�ж����ܵ��磬�Ƿǵ���ʣ�
��AgΪ�������ʣ��Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
�۰�ˮ�ܹ����磬���ǻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
��Һ̬SO3��ˮ��Һ���ܹ����磬���������ܵ��룬�Ƿǵ���ʣ�
��С�մ������ˮ��Һ���ܹ����磬�ǵ���ʣ�
��Fe(OH)3�����ǻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
��FeCl3��Һ���ܹ����磬���ǻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
�����ڵ���ʵ��ǣ��ݣ����ڷǵ���ʵ��ǣ��٢ܣ�
��2��������SO2ͨ��С�մ���Һ�з�����Ӧ�����������ƺͶ�����̼�����ӷ���ʽΪ��2HCO3��+SO2��2CO2+SO32��+H2O��
��3����Һ��ͨ��һ������û��������������ͨ��һ�����߳��ֹ�����·��Ϊ�����������������Һ�ͽ��壻���岻������Ĥ����Һ��������Ĥ�����ð�Ĥ���Է��뽺������Һ������Ϊ������
��4��ʵ�������Ȼ�茶�����������ƾ��������Ʊ���������Ӧ����ʽ��2NH4C1+Ca(OH)2![]() 2NH3��+CaC12+2H2O�������Ǽ������壬ѡ����Ը����������ѡ���ʯ�����������
2NH3��+CaC12+2H2O�������Ǽ������壬ѡ����Ը����������ѡ���ʯ�����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����
A. ��C(ʯī��s)=C(���ʯ��s)��H = +1.9 kJ��mol-1��֪,���ʯ��ʯī�ȶ�
B. ��֪S(g)+O2(g)�TSO2(g) ����1 ��S(s)+O2(g)�TSO2(g) ����2 ,������1<����2
C. ��101kPaʱ,2g H2��ȫȼ������Һ̬ˮ,�ų�285.8kJ����,����ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ2H2(g)+O2(g)![]() 2H2O(l) ��H = +285.8 kJ��mol-1
2H2O(l) ��H = +285.8 kJ��mol-1
D. ��ϡ��Һ��:H +(aq)+OH -(aq)= H2O(l)��H =-57.3 kJ��mol-1,������1mol CH3COOH�뺬1mol NaOH����Һ���,�ų�����������57.3 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ�����ͼװ��̽��ʯ���ͷֽ��������ʣ�����˵���������
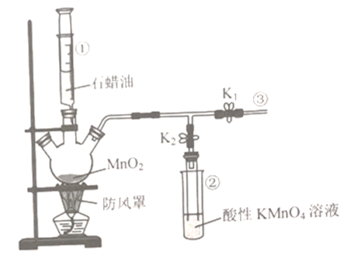
A.�����ٿɿ���ʯ���͵μӵ�����
B.װ�â�������������
C.ʵ������У��ر�K1����K2��װ�â�����Һ��ɫ����ȥ
D.����һ��ʱ��ر�K2����K1���ڢ۴���ȼ����ɿ�������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��ŵ������ѧ���䷢����λ��������ӵ�صĿ�ѧ�ҡ�����ӵ�����������Ǿ��������ܵĹؼ���
��1�������(LiMn2O4)��ؾ���ԭ�ϳɱ��͡��ϳɹ��ռ��ŵ㡣Li+������͵ļ���̬���ӵĵ����Ų�ͼΪ________���þ���ṹ�к���Mn4+����̬Mn4+����۲����ռ�ݵĹ����Ϊ__________________����
��2���������(LiFePO4)��ذ�ȫ�����졢ʹ��������������Pԭ�ӵ��ӻ���ʽΪ__________________�������ӵĿռ�ṹΪ__________________��
��3����Ԫ��������![]() ����Al3+��ʹ�����ܸ��ţ����ĵ����ܣ�Mn__________________Al(����ڡ���С�ڡ�)��ԭ����__________________��
����Al3+��ʹ�����ܸ��ţ����ĵ����ܣ�Mn__________________Al(����ڡ���С�ڡ�)��ԭ����__________________��
��4���黯ﮱ���Ϊ�Ǻ���DZ�����������ϣ������ṹ��ͼ��ʾ��

���������Կ���������ԭ�ӹ��ɵ��������������ԭ����������е�������Ͱ������϶��������Ļ�ѧʽΪ__________________��ͼ����ԭ�����������AΪ(0��0��0)�� BΪ(0��1��1)��CΪ__________________��
������������Ϊanm������ԭ�ӵİ뾶Ϊ__________________nm���������϶�е��ԭ�����������϶�е��ԭ��֮�����̾���Ϊ__________________nm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Fe2O3 ��CuO�Ļ���������H2�����У����ȳ�ַ�Ӧ����ȴ��Ƶ�ʣ������ԭ��������1.6 g��������������ԭ����������ᷴӦ����ʹ֮��ȫ�ܽ⣬��1 mol/L��������������Ϊ(����)
A.0.05 LB.0.1 LC.0.2 LD.0.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е�������������ʱ����Ӧ����(�¶Ȼ�Ӧ�������ı�)�����������������ı����![]()
![]()
A.Na2O2��CO2B.Na2CO3��HCl
C.Na��O2D.NaHSO4��Ba(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��ͬ��ѧԪ����ɵĻ�����ʾ��ͼ������˵������ȷ���� (����)
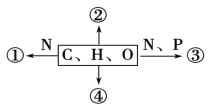
A. ����Ϊij�־��д����õĻ������ٵij���ˮ�����Ϊ���ģ�����ˮ�����Ϊ������
B. ���ڴ���������Ƥ�º�����������Χ�����Ϊ֬��
C. ����Ϊ����ϸ��Ĥ�����Ǽܵķ��ӣ����Ϊ��֬
D. �����ڵ�Ѫ��ʱ�ֽ��Բ���Ѫ�ǣ���ܿ����Ǽ���ԭ����ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��CO��H2O��g������һ��������ʹ��ӦCO��g��+H2O��g��![]() CO2��g��+H2��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó�����ȷ�����ǣ� ��
CO2��g��+H2��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó�����ȷ�����ǣ� ��
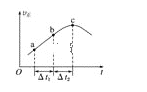
A. ��Ӧ��������������������������
B. ��t1=��t2ʱ��CO��ת���ʣ�a��b��С��bc��
C. ��Ӧ��c��ﵽƽ��״̬
D. ��Ӧ��Ũ�ȣ�a��С��b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ��ü�����Һ���ն������������ֹ��Ⱦ��������ijһ����ȤС��ʵ���н������������100 mL 2.00 mol��L-1��NaOH��Һǡ����ȫ���ա���������Һ���ClO-��![]() �����ʵ���Ũ��֮��Ϊ5��1����ش�
�����ʵ���Ũ��֮��Ϊ5��1����ش�
(1)���յ����������ʵ���Ϊ____mol��
(2)������������ǰ����Һ����仯��������Һ��Cl-�����ʵ���Ũ��Ϊ________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com