
下列各项中可说明HAc是弱电解质的是( )
A.0.1 mol·L-1HAc的pH>1
B.相同温度下,醋酸与强酸溶液的导电性比较
C.相同物质的量浓度、相同体积的醋酸和盐酸分别与足量的活泼金属反应时,消耗金属的量
D.pH=4的醋酸与pH=10的NaOH溶液等体积混合后溶液的酸碱性
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
已知723 K时,2SO2(g)+O2(g)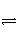
 2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是
2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是
( )
A.Q2=Q1/2 B.Q2<Q1/2 C.Q2>Q1/2 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
xMg+Mo3S4 MgxMo3S4
MgxMo3S4
在镁原电池放电时,下列说法错误的是( )
A.Mg2+向正极迁移
B.正极反应为Mo3S4+2xe-====Mo3S42x-
C.Mo3S4发生氧化反应
D.负极反应为xMg-2xe-====xMg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)  2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),据此得出的结论不正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),据此得出的结论不正确的是( )
A.达到平衡时A2的转化率大小为b>a
B.a、b、c三点的平衡常数相同
C.若T2>T1,则正反应一定是吸热反应
D.b点时,平衡体系中A、B原子数之比一定是1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
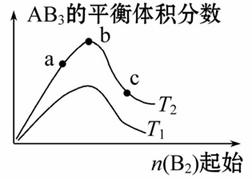
在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定条件下发生如下反应:H2(g)+ I2(g)
I2(g) 2HI(g)
2HI(g)
ΔH<0,反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为__________。
(2)根据图1数据,反应开始至达到平衡时,平均反应速率v(HI)为_______。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K_________(填“增大”“减小”或“不变”),HI浓度的变化正确的是___________(用图2中a~c的编号回答)。
②若加入I2,H2浓度的变化正确的是_______(用图2中d~f的编号回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
比较等物质的量浓度的:①H2SO3;②NaHSO3;③Na2SO3。三种溶液中[SO32-]的大小,排列正确的是( )
A.①>②>③ B.③>②>①
C.②>①>③ D.③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
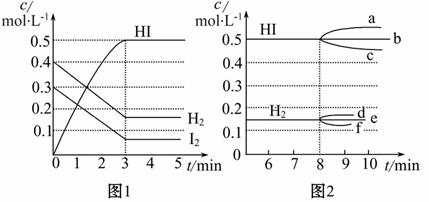
短周期元素甲~丁在元素周期表中的相对位置如表所示,下列判断正确的是(双选)( )
A.原子半径:丙>丁>乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下:4NH3+5O2=4NO+6H2O,若有标准状况下VL氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com