
分析 W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,X是地壳中含量最多的金属元素,所以X是铝,Y、Z是非金属元素,W与Y可形成化合物W2Y,W是第IA族元素,W是钠,则Y是第VIA族元素,则Y是硫,所以Z是氯,由此分析解答.
解答 解:W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,X是地壳中含量最多的金属元素,所以X是铝,Y、Z是非金属元素,W与Y可形成化合物W2Y,W是第IA族元素,则W是钠,Y是第VIA族元素,则Y是硫,所以Z是氯,
(1)W是钠,硫在周期表的位置为三周期ⅦA族,故答案为:钠(Na);第三周期ⅦA族;
(2)Na2S2中存在离子键、共价键,故答案为:离子键、共价键;
(3)单质铝与氢氧化钠反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)①非金属性越强,越容易说明与氢气越易化合,故正确;
②单质的熔点,是物理性质,故错误;
③元素的最高价氧化物对应的水化物酸性越强,元素的非金属性越强,故正确;
④与某金属反应时,得到电子数目的多少无关,而与得电子的难易程度有关,故错误;
故选:①③;
(5)4gY单质在氧气中燃烧,可放出37kJ的热,则1mol的硫放出的热量为:296 kJ,所以反应热为:S(s)+O2 (g)═SO2 (g)△H=-296 kJ/mol,
故答案为:S(s)+O2 (g)═SO2 (g)△H=-296 kJ/mol.
点评 本题考查非金属性的比较,题目难度不大,注意元素非金属性和金属性的比较角度,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
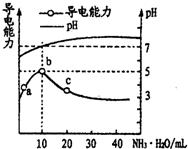
| A. | HR为强酸 | |
| B. | a、b、c三点所示溶液中水的电离程度相同 | |
| C. | b点溶液中c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a~c任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
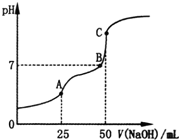
| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有Na2HC2O4和Na2C2O4 | |
| C. | C点时,c(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| D. | A点时,c(Na+)+c(H+)═c(OH-)+c(HC2O4-)+2c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类都能够发生水解 | |
| B. | 蛋白质的水解产物都含有羧基和羟基 | |
| C. | 油脂碱性水解可以制取肥皂和甘油 | |
| D. | 它们都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
| A. | KBr | B. | KI | C. | K2S | D. | K2CrO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com