
| A. | 氯水和二氧化硫使品红溶液褪色 | |
| B. | 稀硝酸和三氯化铁溶液使KI-淀粉试纸变蓝 | |
| C. | 亚硫酸钠和水玻璃长期暴露在空气中变质 | |
| D. | 浓盐酸和浓硫酸长期暴露在空气中浓度变小 |
分析 A.次氯酸漂白性是因为次氯酸具有强氧化性,二氧化硫漂白,是因为可以和有色物质化合生成无色物质;
B.稀硝酸和三氯化铁都具有强的氧化性,能够氧化碘离子;
C.亚硫酸根具有强的还原性,容易被氧化成硫酸根,硅酸钠能够与空气中的二氧化碳反应;
D.浓盐酸易挥发,浓硫酸具有吸水性.
解答 解:A.氯水使品红溶液褪色是因为有色物质被氧化成无色物质,二氧化硫使品红溶液褪色是因为与有色物质发生化合反应生成无色物质,二者原理不同,故A错误;
B.稀硝酸和三氯化铁都具有强的氧化性,能够氧化碘离子生成单质碘,故B正确;
C.亚硫酸钠被空气中的氧气氧化而变质,水玻璃长期暴露在空气中变质是因为与二氧化碳反应,二者原因不同,故C错误;
D.浓盐酸和浓硫酸长期暴露在空气中浓度变小,原因不同,浓盐酸是因为氯化氢挥发,溶质的物质的量减少,浓硫酸是因为具有吸水性,溶剂增多,故D错误;
故选B.
点评 本题考查了常见无机物质的性质,题目难度不大,熟悉各种物质的性质是解题的关键,注意A选项为易错选项.


科目:高中化学 来源: 题型:选择题
| A. | 氮原子的价电子排布图: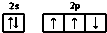 | |
| B. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| C. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| D. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑩ | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
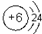 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
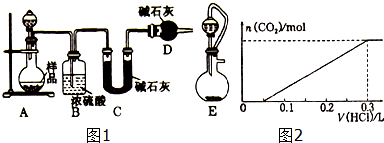
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
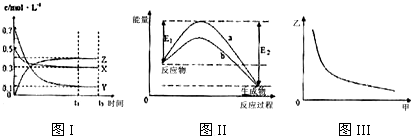
| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ•mol-1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线a是加入催化剂时的能量变化曲线,曲线b是没有加入催化剂时的能量变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①③④⑤ | C. | ①②③④⑥ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
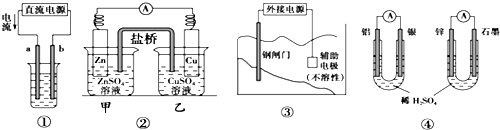
| A. | 用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 图②装置的盐桥中KCl的Cl-移向甲烧杯 | |
| C. | 图③装置中钢闸门应与外接电源的负极相连以获得保护 | |
| D. | 图④两个装置中通过导线的电流相同时(忽略电阻和其它能量损耗),消耗负极材料的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 起始时各物质的物质的量/mol | 达平衡时能量的变化 | |||
| N2 | H2 | NH3 | Ar | ||
| ① | 1 | 3 | 0 | 0 | 放出热量Q1 |
| ② | 0.9 | 2.7 | 0.2 | 0 | 放出热量Q2 |
| ③ | 0.9 | 2.7 | 0.2 | 0.1 | 吸收热量Q3 |
| A. | 放出热量大小:Q1 >Q2 =Q3 | B. | 容器中的压强:③>①=2 | ||
| C. | N2的转化率:①<②<③ | D. | 平衡时NH3的体积分数:①=②<③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com