
| A、除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 |
| B、除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 |
| C、可以用溴水鉴别乙醇、甲苯、四氯化碳、植物油 |
| D、只用银氨溶液就可以鉴别淀粉是否完全水解 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮气的电子式:N??N |
| B、乙烯的结构简式:CH2CH2 |
| C、二氧化碳分子的结构式:O-C-O |
D、CH4分子的球棍模型: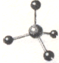 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:3 |
| C、1:6 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的性质随着原子序数的递增而呈周期性变化 |
| B、随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 |
| C、随着元素原子序数的递增,元素的最高化合价从+1到+7,最低化合价从-7到-1重复出现 |
| D、元素性质的周期性变化是指相对原子量的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com