
【题目】某废铝屑中含有少量杂质Al2O3、SiO2。取一定量该废铝屑样品,加入2mol/L的硫酸溶液,消耗600mL硫酸溶液时样品不再溶解,收集到标准状况下的气体8.96 L,过滤。欲使滤液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A.300mLB.600mLC.800mLD.900mL
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】已知常温下Cu能与Fe3+发生反应:Cu+2Fe3+=Cu2++2Fe2+现将铜粉与二氧化二铁的混合物22.4g加入到1mol/L的H2SO4溶液中进行反应。
(1)若固体恰好溶解,消耗硫酸的体积为V,则V的取值范围是_______。
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中Fe2+的浓度为0.1mol/L,则混合物中含铜_______g或_______g(只需写出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
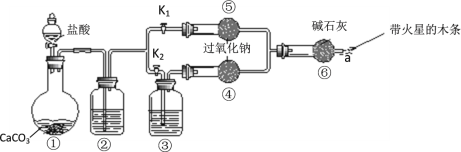
(装置分析)
(1)装置①中反应的离子方程式是___________;
(2)装置②中的试剂是______(填字母),装置③中的试剂是_________(填字母);
a 饱和NaHCO3溶液 b 饱和Na2CO3溶液 c 浓H2SO4 d NaOH溶液
(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(3)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
步骤1中_____________,步骤2中_____________;
(4)步骤2中过氧化钠跟二氧化碳反应的化学方程式是_______________;
(实验反思)
(5)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应” 。其理由是____________;
(6)需要补充的实验操作是:取⑤中反应后的少量固体,______________;
(测定实验)测定反应后⑤中固体CO32-的质量分数
(7)将反应后⑤中固体,称量质量为ag。将ag固体溶于水,加入__________(填“BaCl2”或“CaCl2”)溶液,与未选物质相比的优点是___________。将生成的沉淀过滤、洗涤、干燥、称量,得固体质量为bg,计算质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求写出相应的化学方程式。
(1)乙二酸与乙二醇通过缩聚反应生成聚酯: ________。
(2)对苯二甲酸与乙二醇合成涤纶: ________________。
(3)苯酚与甲醛合成线状酚醛树脂: ___________。
(4)1,3-丁二烯合成顺丁橡胶: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO4具有强氧化性,可用作炸药等。实验室由KClO3分解制备KClO4的流程如图:

已知KClO3熔融易烧结,400℃以上分解放出氧气,各物质溶解度如下图。下列说法不正确的是
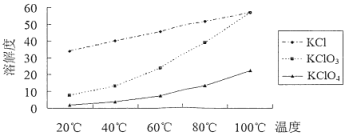
A.实验室制备KClO4的原理为![]()
B.趁热过滤的目的是除去KCl
C.操作①是冷却结晶、过滤、洗涤,操作②是重结晶
D.加热分解时,如果温度过高会使产率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
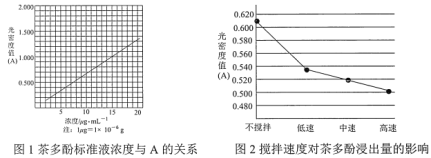
【题目】茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与![]() 生成的深蓝色配位化合物
生成的深蓝色配位化合物![]() 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图1所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图1所示:
某实验小组设计如下实验流程从茶叶中提取茶多酚:
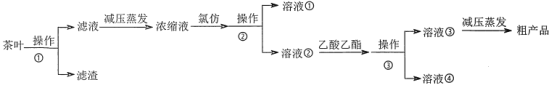
请回答下列问题:
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图2所示,原因是____。若用乙醇浸取茶多酚操作如下:称取10g茶叶末,用滤纸包好,装入恒压滴液漏斗中,圆底烧瓶内加沸石和适量乙醇,如图3安装后,通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在90℃。为使恒压漏斗内液面高出茶叶包约0.5cm,并保持约1h,可行的操作方法是____。
(2)减压蒸发相对于一般蒸发的优点是____。氯仿的作用是____。
(3)下列有关实验基本操作不正确的是___。
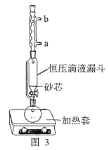
A. 图3中冷凝水流向为a进b出
B. 分液漏斗使用前须检验是否漏水并洗净备用
C. 操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D. 萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)下列关于振摇操作的示意图,正确的是____。
A. 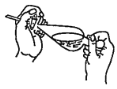 B.
B. 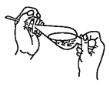 C.
C. 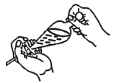 D.
D. 
(5)称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量Fe3+和![]() 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值A=0.800,则产品的纯度是____(以质量分数表示)。
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值A=0.800,则产品的纯度是____(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所给信息或标志,判断下列说法错误的是()
A.在实验室和生产生活中,安全都是避免伤害和事故的保障—用肥皂液涂在天然气管道接口处检验是否漏气
B. 在运送硫酸的油罐车上贴有该标志
在运送硫酸的油罐车上贴有该标志
C. 看到有该标志的丢弃物,应远离并报警
看到有该标志的丢弃物,应远离并报警
D. 贴有该标志的物品是可回收物
贴有该标志的物品是可回收物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F均为周期表中前四周期的元素,原子序数依次增大。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体可做半导体材料;F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为________
(2)B的氯化物的熔点比D的氯化物的熔点高的理由是____________。
(3)A的简单氢化物的中心原子采取______杂化,E的低价氧化物分子的空间构型是____。
(4)F的核外电子排布式是_____,A、F形成某种化合物的晶胞结构如图所示(其中A显-3价),则其化学式为_______。
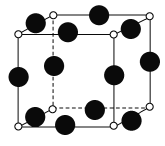
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物既与硫酸反应,又与氢氧化钠反应的是( )
①NaHCO3 ②NaHSO4 ③(NH4)2CO3 ④NaNO3 ⑤Al(OH)3
A.只有①B.只有③C.①②③D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com