
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
分析 A.200g63%的浓硝酸中,硝酸和水中均含有氧原子;
B.二氧化锰只能与浓盐酸反应,和稀盐酸不反应;
C.燃料电池中正极发生还原反应,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应得到4mol电子;
D.醋酸钠溶液中醋酸根离子水解减少.
解答 解:A、200g63%的浓硝酸中,则126g的硝酸中含有氧原子个数为3NA,在74g的水中还含有氧原子,故A错误;
B.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,即盐酸不能反应完全,故转移的电子数小于0.3NA个,故B错误;
C.标况下22.4L气体的物质的量为1mol,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应转移了4mol电子,则电路中通过的电子数目为4NA,故C错误;
D.若CH3COONa溶液中CH3COO-的数目为6NA,醋酸钠溶液中醋酸根离子水解减少,则Na+的数目大于6NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是盐类水解、原电池反应中的电子转移计算、氧化还原反应电子转移计算,气体摩尔体积的条件应用分析,掌握基础是关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
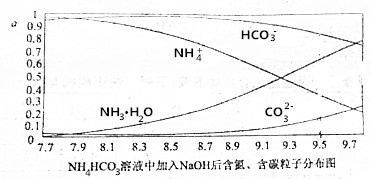
| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
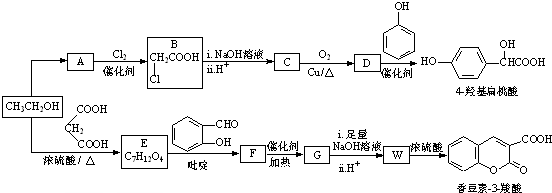
 (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基) $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$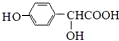 .
.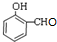 $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$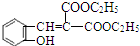 +H2O.
+H2O.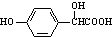 )的同分异构体
)的同分异构体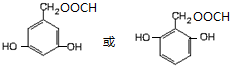 .
.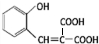 $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$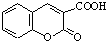 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01kJ•mol-1 |
| 反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |
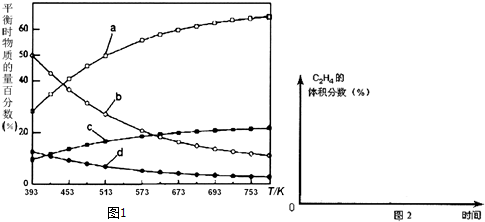
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
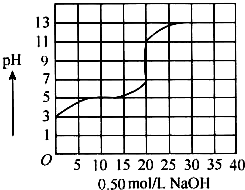 在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )| A. | 盐酸在滴定前的浓度是0.3mol/L | |
| B. | 该盐酸稀释10倍后pH为4 | |
| C. | 滴定过程为求滴定终点,指示剂只能用酚酞 | |
| D. | 若用酚酞作指示剂,滴定终点时溶液颜色的变化为红色到无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
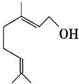 香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )| A. | 香叶醇的分子式为C10H18O | B. | 不能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生加成反应不能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
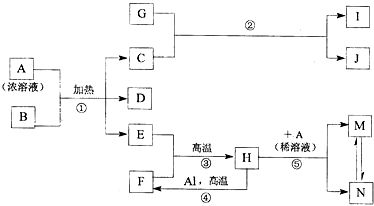
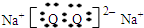 ,化合物J的俗名纯碱.
,化合物J的俗名纯碱.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

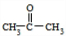 .
.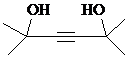 .
.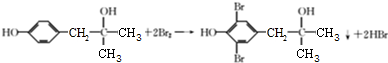 .
.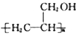 的合成路线图(无机试剂任用).合成路线图示例如下:
的合成路线图(无机试剂任用).合成路线图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com