
【题目】向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )
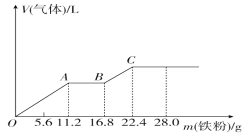
A.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2
B.A点溶液中的溶质为Fe(NO3)3和H2SO4
C.原混合酸中NO3-物质的量为0.2 mol
D.原混合酸中H2SO4的物质的量浓度为2 mol·L-1
【答案】B
【解析】
由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑;最终消耗22.4gFe,溶液中溶质为FeSO4,根据Fe元素守恒可以计算n(FeSO4),进而计算硫酸的物质的量浓度。
A.根据分析可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,所以OA段产生的是NO,BC段产生H2,A选项正确;
B.A点时,NO3-被Fe全部还原为NO,因此溶液中不再含有NO3-,B选项错误;
C.OA段消耗11.2gFe,即0.2molFe,根据方程式Fe+NO3-+4H+=Fe3++NO↑+2H2O可知消耗的HNO3的物质的量为0.2mol,因此原混合酸中NO3-物质的量为0.2 mol,C选项正确;
D.最终消耗22.4gFe,即0.4molFe,最后溶液中溶质为FeSO4,根据Fe元素守恒可得n(FeSO4)=0.4mol,则n(H2SO4)=0.4mol,原混合酸中H2SO4的物质的量浓度为![]() ,D选项正确;
,D选项正确;


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出。下列说法正确的是
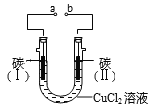
A. a为电源负极
B. 电极Ⅱ上发生还原反应
C. 电子流向:a→Ⅰ→Ⅱ→b
D. 该装置将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
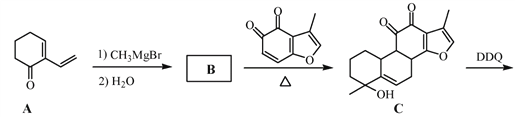
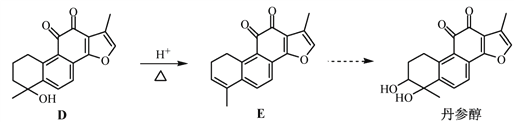
已知:![]()
(1)A中的官能团名称为__________________(写两种)。
(2)D![]() E的反应类型为__________________。
E的反应类型为__________________。
(3)B的分子式为C9H14O,写出B的结构简式:__________________。
(4)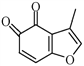 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以![]() 和
和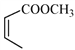 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道中有三个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______。
(2)C元素的第一电离能比氧元素的第一电离能_____(填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是______,CA3分子的空间构型是_____。
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_______。
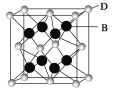
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,将溶液a逐滴加入固体b中,下列叙述中不正确的是( )

A.若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液褪色
B.若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊
C.若a为浓硫酸,b为Na2SO3固体,c中盛紫色石蕊溶液,则c中溶液变红
D.若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
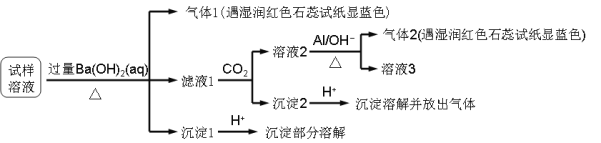
已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行)![]() :A
:A![]() B
B![]() C;
C;
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
(1)在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为_______。
(2)工业上常用过量的Na2CO3溶液吸收C,生成等物质的量的两种硝酸盐,该反应的离子方程式为___。
Ⅱ.若A、C、W都是常见气体,C是导致酸雨的主要气体,常温下A与C反应生成B,则该反应的化学方程式为_____。
某化学活动小组将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________。
Ⅲ.A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。若将标准状况下2.24L的W通入150mL1 molL-1 的A溶液中,充分反应。总反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨甲环酸(G)别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略):
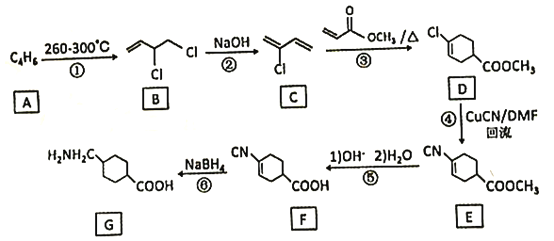
回答下列问题:
(1)A的结构简式是____。C的化学名称是_______。
(2)G在NaOH催化下发生双分子脱水形成仅含两个环的有机物,写出该反应的化学反应方程式____。
(3)①~⑥中属于取代反应的是_________。
(4)E中不含N原子的官能团名称为___________。
(5)氨甲环酸(G)的分子式为__________。
(6)满足以下条件的所有E的同分异构体有_____种。
a.含苯环 b.含硝基 c.苯环上只有两个取代基
(7)写出以![]() 和CH2=CHCOOCH2CH3为原料,制备
和CH2=CHCOOCH2CH3为原料,制备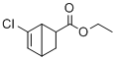 的合成路线:_______(无机试剂任性)
的合成路线:_______(无机试剂任性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是_________(填“吸热”或“放热”)反应,NO2和CO的总能量_________(填“小于”、 “大于”或“等于”)CO2和NO的总能量。
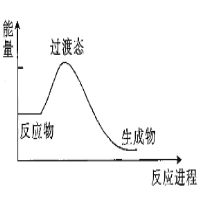
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:NO2+COCO2+NO,2min时,测得容器中NO的物质的量为0.2mol,则:
①该段时间内,用CO2表示的平均反应速率为_________。
②假设此反应在5min时达到平衡,则此时容器内气体的总物质的量为_________。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_________。
A.容器内气体的质量保持不变
B.NO2的物质的量浓度不再改变
C.NO2的消耗速率与CO2的消耗速率相等
D.容器内气体总的物质的量保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com