
 在实验条件许可的情况下,实验室也可以进行某些有机物的制备.实验室制备溴乙烷(C2H5Br)的装置和步骤如下(已知溴乙烷的沸点38.4℃,密度比水大,难溶于水):
在实验条件许可的情况下,实验室也可以进行某些有机物的制备.实验室制备溴乙烷(C2H5Br)的装置和步骤如下(已知溴乙烷的沸点38.4℃,密度比水大,难溶于水):分析 (1)乙醇、浓硫酸和溴化钠加热反应生成溴乙烷、硫酸氢钠和水;
(2)浓硫酸具有强氧化性,温度过高会把溴离子氧化成红棕色的溴,同时浓硫酸被还原成二氧化硫;
(3)为了更好的控制温度,最好用水浴加热的方法;
(4)U型管得到了溴乙烷;溴乙烷中混有溴,除杂时注意溴和溴乙烷的性质角度考虑;分液用到分液漏斗;将溴乙烷与水分离采用蒸馏操作;
(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成;有溴乙烷参加的主要反应是溴乙烷和碱溶液中的水解.
解答 解:(1)溴化钠、浓硫酸和乙醇制取溴乙烷的化学方程式为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,
故答案为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O;
(2)由于浓硫酸具有强氧化性,会有溴生成,化学式为Br2,同时浓硫酸被还原成SO2,为无色气体,
故答案为:Br2;SO2;
(3)为了更好的控制温度,最好用水浴加热的方法,
故答案为:水浴加热;
(4)在U型管内有制取的溴乙烷,所以现象是U型管底部有油状液体沉积,粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则,a.溴乙烷能够与氢氧化钠反应,故a错误;
b.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,故b错误;
c.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故c正确;
d.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故d错误;
分液使用的主要仪器是分液漏斗;要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,利用沸点不同再进行蒸馏分离,
故答案为:U型管底部有油状液体沉积;c;分液漏斗;蒸馏;
(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为④①⑤③②,
故答案为:④①⑤③②.
点评 本题主要考查了溴乙烷的制备,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,本题难度中等.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 氯气长时间放置后酸性减弱 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
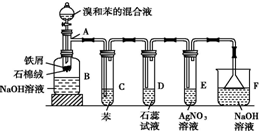 (1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中用苯甲醛制备苯甲醇和苯甲酸,已知反应原理:2HCHO+KOH-→CH3OH+HCOOK
实验室中用苯甲醛制备苯甲醇和苯甲酸,已知反应原理:2HCHO+KOH-→CH3OH+HCOOK
 ,实验室在收集此特殊香味的物质时常用饱和Na2CO3溶液 (填试剂名称)除去其中的杂质,且便于其分层析出.
,实验室在收集此特殊香味的物质时常用饱和Na2CO3溶液 (填试剂名称)除去其中的杂质,且便于其分层析出.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是甲、乙两种物质的溶解度曲线.在t2℃时向盛有100g水的烧杯中先后加入wg甲和wg乙(两种物质溶解时互不影响),充分搅拌.将混合物的温度降低到t1℃.下列说法正确的是( )
如图是甲、乙两种物质的溶解度曲线.在t2℃时向盛有100g水的烧杯中先后加入wg甲和wg乙(两种物质溶解时互不影响),充分搅拌.将混合物的温度降低到t1℃.下列说法正确的是( )| A. | 甲物质的溶解度随温度升高而减小 | |
| B. | 温度降低到t1℃时,得到甲、乙的饱和溶液 | |
| C. | 温度降低到t1℃时,甲、乙的溶质质量分数相等,得到甲、乙的不饱和溶液 | |
| D. | t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银镜、氨水 | B. | 石蜡、蒸馏水 | C. | 油脂、碱液 | D. | 硫黄、酒精 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com