
【题目】下列有关离子晶体的数据大小比较不正确的是( )
A. 晶格能:NaF>NaCl>NaBr
B. 硬度:MgO>CaO>BaO
C. 熔点:NaF>MgF2>AlF3
D. 阴离子的配位数:CsCl>NaCl>CaF2
【答案】C
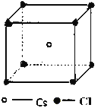
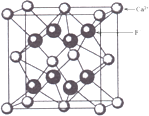
【解析】A、离子半径越小,所带电荷数越大,晶格能越大;B、根据原子半径大小比较键能,根据键能大小比较硬度;C、从离子半径以及电荷的角度比较晶格能,根据晶格能大小比较;D、根据NaCl、CsCl、CaF2的晶胞结构分别为: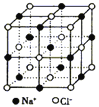 、
、 、
、 分析。
分析。
A、离子半径Br->Cl->F-,离子半径越小,所带电荷数越大,晶格能越大,故A正确;B、原子半径Ba>Ca>Mg,原子半径越大,键能越小,硬度越小,故B正确;C、离子半径Na+>Mg2+>Al3+,离子半径越小,电荷越多,晶格能越大,则熔点越高,故C错误;D、NaCl、CsCl、CaF2的晶胞结构分别为: 、
、 、
、 ,结合图可知,CsCl为立方体心结构,Cl-的配位数是8;在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8,在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4;NaCl为立方面向结构,钠离子的配位数为6,Cl-的配位数是6,则阴离子的配位数:CsCl>NaCl>CaF2,故D正确;故选C。
,结合图可知,CsCl为立方体心结构,Cl-的配位数是8;在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8,在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4;NaCl为立方面向结构,钠离子的配位数为6,Cl-的配位数是6,则阴离子的配位数:CsCl>NaCl>CaF2,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含有碳、氢、氧三种元素的化合物一定是有机物
B.有机物都难溶于水,都是非电解质
C.烃是含有碳元素和氢元素的化合物
D.甲烷是最简单的烃类有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与NaOH溶液共热反应的化学方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的反应2SO3(g)![]() O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是( )
O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是( )
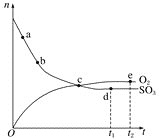
A. 点c处反应达到平衡B. 点b的正反应速率比点a的大
C. 点c的逆反应速率比点e的大D. 点d(t1时刻)和点e(t2时刻)处n(SO2)一样大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数( )
A. 只有x+1 B. 可能是x+8
C. 可能是x+2 D. 可能是x+1或x+11或x+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是

A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中SO42-物质的量为0.6 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制取、洗涤并测量生成气体体积的装置示意图,利用上述装置进行下表所列实验,能达到试验目的是( )
物质实验 | a(液体) | b(固体) | c(液体) |
A | 稀盐酸 | 锌粒 | 浓H2SO4 |
B | 浓盐酸 | MnO2 | 浓H2SO4 |
C | 稀硫酸 | CaCO3 | 浓H2SO4 |
D | 浓氨水 | 生石灰 | 浓H2SO4 |

A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com