

分析 红色固体B中加硫酸、KSCN溶液后变为血红色,则B为Fe2O3,气体D通入品红溶液褪色,加热后红色恢复,则D为SO2,晶体X中结晶水的质量为5.56g-1.6g-0.8g-0.01mol×64g/mol=2.52g,结晶水的物质的量为$\frac{2.52g}{18g/mol}$=0.14mol,5.56g晶体X的物质的量为$\frac{5.56g}{278g/mol}$=0.02mol,则结晶水数目为$\frac{0.14mol}{0.02mol}$=7,即晶体X化学式表示为A.7H2O,A的相对分子质量为278-18×7=152,A的质量为1.6g+0.8+0.01mol×64g/mol=3.04g,A的物质的量为$\frac{3.04g}{152g/mol}$=0.02mol,Fe2O3的物质的量为$\frac{1.6g}{160g/mol}$=0.01mol,SO2物质的量为0.01mol,则2A$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+xE↑,E冷却得到无色晶体,应是SO3,则A为FeSO4,X为FeSO4.7H2O.
解答 解:红色固体B中加硫酸、KSCN溶液后变为血红色,则B为Fe2O3,气体D通入品红溶液褪色,加热后红色恢复,则D为SO2,晶体X中结晶水的质量为5.56g-1.6g-0.8g-0.01mol×64g/mol=2.52g,结晶水的物质的量为$\frac{2.52g}{18g/mol}$=0.14mol,5.56g晶体X的物质的量为$\frac{5.56g}{278g/mol}$=0.02mol,则结晶水数目为$\frac{0.14mol}{0.02mol}$=7,即晶体X化学式表示为A.7H2O,A的相对分子质量为278-18×7=152,A的质量为1.6g+0.8+0.01mol×64g/mol=3.04g,A的物质的量为$\frac{3.04g}{152g/mol}$=0.02mol,Fe2O3的物质的量为$\frac{1.6g}{160g/mol}$=0.01mol,SO2物质的量为0.01mol,则2A$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+xE↑,E冷却得到无色晶体,应是SO3,则A为FeSO4,X为FeSO4.7H2O.
(1)D的分子式为SO2,故答案为:SO2;
(2)A强热分解的化学方程式为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(3)FeSO4水溶液中Fe2+离子水解,溶液呈酸性,故溶液中各离子浓度由大到小的顺序为:c(SO42-)>c(Fe2+)>c(H+)>c(OH-),故答案为:c(SO42-)>c(Fe2+)>c(H+)>c(OH-);
(4)氧化铁与NH3的化学方程式为:2NH3+Fe2O3=2Fe+N2+3H2O,故答案为:2NH3+Fe2O3=2Fe+N2+3H2O.
点评 本题考查无机物推断,物质颜色及反应现象为推断突破口,侧重考查学生分析推理能力,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 推广或使用新能源汽车有助于减少氮氧化物的排放 | |
| B. | “硫黄姜”又黄又亮,可能是在用硫黄熏制过程中产生的SO2所致 | |
| C. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的晶体硅 | |
| D. | 原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物中的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室采用排饱和食盐水的方法收集氯气 Cl2+H2O?H++Cl-+HClO | |
| B. | 500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0 | |
| C. | H2、I2、HI平衡混合气体加压后颜色加深 H2(g)+I2(g)?2HI(g) | |
| D. | SO2氧化为SO3,往往需要使用催化剂 2SO2(g)+O2(g)?2SO3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.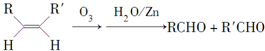
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙醇与钠的反应是①键断裂 | |
| B. | 乙醇的催化氧化反应是②③键断裂 | |
| C. | 乙醇的燃烧氧化反应是所有化学键都断裂 | |
| D. | 乙醇与乙酸发生酯化反应是①键断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能与NaOH溶液反应而乙醇不能 | |
| B. | 与Na反应时,乙醇的反应速率比水慢 | |
| C. | 乙醇能被酸性重铬酸钾溶液氧化而乙酸不能 | |
| D. | 苯、甲苯发生硝化反应生成一硝基取代产物时,甲苯的反应温度更低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com