
【题目】一定温度下,在密闭容器中发生如下反应:N2O4(g)![]() 2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
A.若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深
B.若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变
C.若体积不变,向容器中再加入一定量的N2O4,平衡向逆反应方向移动,再次平衡时N2O4的体积分数将增大
D.若体积不变,升高温度,再次平衡时体系颜色加深
【答案】C
【解析】
A、缩小容器的体积,物质浓度增大,压强增大平衡逆向进行,二氧化氮是红棕色气体,四氧化二氮是无色气体,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深,故A正确;
B、若压强不变,向容器中再加入一定量的N2O4,体积增大,最后达到相同平衡状态,故B正确;
C、若体积不变,向容器中再加入一定量的N2O4,平衡正向进行,将新平衡看成是新加入的N2O4自身形成的平衡和旧平衡的融合,由于新加入的N2O4的自身转化率没有原先N2O4的转化率高,所以平衡时N2O4的体积分数将降低,故C错误;
D、反应是吸热反应,升温平衡向正向进行,再次平衡时体系颜色加深,故D正确;
故选:C。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式___________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为___________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量___________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比____________。②吸收后氨水的物质的量浓度_______________(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
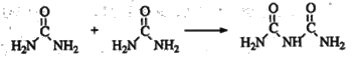 +NH3
+NH3
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1 和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1 周围产生细小气泡,C2 周围无明显现象;持续通电一段时间后,C2 周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。关于该实验的说法不正确的是

A.C1电极产生气泡原因:![]()
B.可以用两根铁钉代替铅笔芯完成实验
C.自制消毒剂的总反应为:NaCl+H2O ![]() NaClO+H2↑
NaClO+H2↑
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,四种均为0.1molL﹣1的溶液,其pH如下表所示,下列关系不正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaHCO3 |
|
pH | 7.0 | 7.0 | 8.4 | 9.9 |
A.酸性:H2CO3>![]()
B.水电离产生的c(H+):①=②
C.溶液③中:c(HCO3-)+c(CO32-)+c(H2CO3)= 0.1molL﹣1
D.溶液④中:c(Na+)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是PH3,其结构式为___________,下列有关PH3的说法错误的是___________。
a.PH3分子是极性分子
b.PH3分子稳定性低于NH3分子,因为N-H键键能高
c.一个PH3分子中,P原子核外有一对孤电子对
d.PH3沸点低于NH3沸点,因为P-H键键能低
(2)“荧光”产生的原理是Ca3P2在潮湿的空气中剧烈反应,写出该反应的化学方程式____________________。
(3)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H | 白磷分子结构 |
键能/(kJ·mol-1) | 213 | 436 | 322 |
|
则反应4PH3(g)![]() P4(g)+6H2(g) △H=___________ kJ· mol-1。
P4(g)+6H2(g) △H=___________ kJ· mol-1。
(4)某温度下,向容积为2L的密闭容器中通入2 mol PH3发生(3)中反应,5min后反应达平衡,测得此时H2的物质的量为1.5 mol,则用PH3表示的这段时间内的化学反应速率v(PH3)=__________;下列说法能表明该反应达到平衡状态的是___________。
A.混合气体的密度不变 B.6v(PH3)=4v(H2)
C.c(PH3):c(P4):c(H2)=4:1:6 D.混合气体的压强不变
(5)PH3有毒,白磷工厂常用Cu2+、Pd2+液相脱除PH3:PH3+2O2![]() H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:
H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:

(I)由图可知,富氧有利于____________(选填“延长”或“缩短”)催化作用的持续时间。
(Ⅱ)随着反应进行,PH3的净化效率急剧降低的原因可能为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化生产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1= + 41.1 kJmol-1 CO(g)+2H2(g)
H2O(g) +CO(g) ΔH1= + 41.1 kJmol-1 CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_________________________________。
(2)为提高CH3OH产率,理论上应采用的条件是_______________________(填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X 平衡转化率变化曲线。

① 反应物X 是_____(填“CO2”或“H2”)。
② 判断依据是_____。
(4)250℃、在体积为 2.0L 的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min 时反应达到平衡,测得 c(CH3OH) = 0.75 mol·L-1。
① 前 10min 的平均反应速率 v(H2)=_____mol·L-1·min-1。
② 经计算化学平衡常数 K =_____________________。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO 纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO 纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO 纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO 纳米片 | 12.0 | 70.6 |
(注:甲醇选择性是指的是转化的CO2中生成甲醇的百分含量)
根据上表所给数据,用CO2生产甲醇的最优选项为_____(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,乳酸的摩尔质量为90g/moL;“A-”表示乳酸根离子)。则下列说法不正确的是

A.交换膜 I为只允许阳离子透过的阳离子交换膜
B.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C.电解过程中采取一定的措施可控制阴极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。设200mL 20g/L乳酸溶液通电一段时间后阴极上产生的H2在标准状况下的体积约为6.72L,则该溶液浓度上升为155g/L(溶液体积变化忽略不计)
D.浓缩室内溶液经过电解后pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com