
| A. | 物质的量之比为1:1 | B. | 密度之比为4:11 | ||
| C. | 体积之比为4:11 | D. | 原子数之比为5:3 |
分析 A.依据n=$\frac{m}{M}$计算判断;
B.同温同压下,气体密度之比等于其摩尔质量之比;
C.同温同压下,气体体积之比等于物质的量之比;
D.依据甲烷与一氧化氮物质的量及分子构成解答.
解答 解:A.依据n=$\frac{m}{M}$,质量一定时,n与M成反比,则等质量的甲烷(CH4)和N2O两种气体相比较,物质的量之比为:44:16=11:4,故A错误;
B.同温同压下,气体密度之比等于其摩尔质量之比,则同温同压下,等质量的甲烷(CH4)和N2O两种气体相比较,密度之比为:16:44=4:11,故B正确;
C.同温同压下,气体体积之比等于物质的量之比,则同温同压下,等质量的甲烷(CH4)和N2O两种气体相比较,体积之比为:44:16=11:4,故C错误;
D.同温同压下,等质量的甲烷(CH4)和N2O两种气体相比较,原子数之比为:11×5:4×3=55:12,故D错误;
故选:B.
点评 本题考查物质的量的有关计算,侧重学生计算能力的考查,注意把握有关计算公式及阿伏伽德罗定律的推论即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 取等体积、pH相同的醋酸和盐酸分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m<n | |
| B. | 将pH=2的CH3COOH溶液加水稀释,水的电离平衡也向右移动 | |
| C. | 常温下,将pH=2的H2SO4与pH=12的NH3•H2O溶液等体积混合后,混合液pH<7 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入酚酞呈红色的溶液中:CO32-、NH4+、NO3-、K+ | |
| B. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| C. | 强酸性溶液中:Fe3+、NH4+、Cl-、SCN- | |
| D. | 含有NaHSO4的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
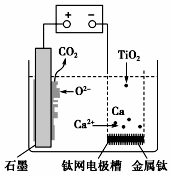 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )| A. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| B. | 阳极的电极反应式为C+2O2--4e-═CO2↑ | |
| C. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子 | |
| D. | 若用铅蓄电池作供电电源,“-”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 190 | B. | 218 | C. | 436 | D. | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
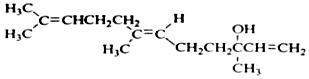 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com