
分析 (1)CO2溶于水形成碳酸,饱和碳酸溶液的pH=5.6,二氧化硫溶于水生成亚硫酸,空气中亚硫酸被氧化为硫酸;
(2)漂白粉制备是氯气和氢氧化钙反应生成次氯酸钙、氯化钙和水,其中次氯酸钙具有强氧化性具有漂白作用;
(3)小苏打可用于治疗胃酸过多是碳酸氢钠和盐酸反应;
(4)KA1(SO4)2•12H2O为明矾晶体,溶于水溶液中铝离子水解生成氢氧化铝胶体具有吸附悬浮杂质的作用;
(5)二氧化碳被氢氧化钠吸收易拉罐变瘪,铝和氢氧化钠溶液反应生成氢气,易拉罐又鼓胀起来.
解答 解:(1)CO2溶于水形成碳酸,饱和碳酸溶液的pH=5.6,酸雨是二氧化硫溶于水生成的亚硫酸被空气氧化深层次硫酸,溶液PH小于5.6,
故答案为:5.6;
(2)氯气与消石灰发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,产生漂白粉,漂白粉的主要成分是CaCl2和Ca(ClO)2的混合物,有效成分是Ca(ClO)2,它之所以能消毒杀菌是因有强的氧化性,
故答案为:Ca(ClO)2;氧化;
(3)NaHCO3与胃酸即盐酸发生复分解反应,产生CO2和水,反应的离子方程式是:HCO3-+H+=CO2↑+H2O,
故答案为:HCO3-+H+=CO2↑+H2O;
(4)KAl(SO4)2•12H2O的俗名为明矾,该盐是强酸弱碱盐,电离产生的Al3+与水电离产生的OH-结合形成表面积比较大的Al(OH)3胶体而有吸附作用,使水中悬浮的固体被吸附,当重力大于浮力时,就形成沉淀,从而使水变得澄清,因此有净水作用,
故答案为:明矾;Al(OH)3;
(5)金属铝能和强碱反应生成氢气,导致罐内气体压强又增大而重新鼓起,金属铝能和强碱反应是实质是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查了酸雨形成、|漂白粉制备、碳酸氢钠性质、铝及其化合物等知识点,注意知识积累,题目难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二醛(OHC-CHO)是一种重要的精细化工产品.工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛.
乙二醛(OHC-CHO)是一种重要的精细化工产品.工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛. +2NH2OH•HCl→
+2NH2OH•HCl→ +2HCL+2H2O)
+2HCL+2H2O)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | Mg2+ | Ca2+ | K+ | Li+ | Cl- | SO42- | Br- |
| 含量/mg•L-1 | 9965 | 1200 | 400 | 380 | 0.17 | 19350 | 1200 | 67 |
| 实验操作 | 实验现象 |
| Ⅰ.取1mL海水,加入1mL0.1mol/L的NaOH溶液 | 有白色沉淀 |
| Ⅱ.取1mLCaCl2溶液,加入1mL0.1mol/L的NaOH溶液 | 无白色沉淀 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04mol/(L•s) | B. | 0.06mol/(L•s) | C. | 0.12mol/(L•s) | D. | 0.08mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: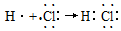 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═2Fe2++Fe3++4H2O | |
| C. | 将金属铝加入NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:
某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com