
| A、C元素的最高正价为+7价 |
| B、离子半径:A2->C->B2+ |
| C、对应气态氢化物的稳定性:A>C |
| D、还原性:A2->C- |


科目:高中化学 来源: 题型:
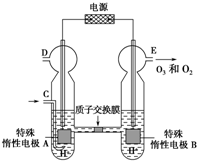 臭氧O3是常用消毒剂,实验室可用电解稀硫酸制备,装置如图(已知溶液中放电顺序:O2>H+).下列说法正确的是( )
臭氧O3是常用消毒剂,实验室可用电解稀硫酸制备,装置如图(已知溶液中放电顺序:O2>H+).下列说法正确的是( )| A、若C处通入O2,电解时溶液中的质子由A极向B极迁移 | ||||
| B、若C处通入O2,A极的电极反应式为:2H++2e-═H2↑ | ||||
C、若C处不通入O2,该制备过程总反应的化学方程式为:3O2
| ||||
D、若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况下),则E处收集的y L气体中O3所占的体积分数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象或原理 |
| A | 将海带灼烧,加水浸泡后过滤,向滤液中加入CCl4 | 液体分层,下层显紫红色 |
| B | 向氢氧化钠铝胶体中逐滴加入稀盐酸或氢氧化钠稀溶液 | 均先出现沉淀后溶解 |
| C | 将40.0g NaOH固体溶于1.0L蒸馏水中配成溶液 | NaOH的物质的量浓度为1.0mol?L-1 |
| D | 向BaSO4饱和溶液中加入饱和Na2CO3溶液 | 有白色沉淀产生,说明KspSO4大于Ksp(BaCO3) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3(s) |
| B、水 |
| C、K2SO4(aq) |
| D、(NH4)2SO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应不再进行 |
| B、反应体系中的c(N2)不再发生变化 |
| C、c(N2O)=c(N2) |
| D、N2O的分解速率与生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、K+、Cl-、CO32- |
| B、K+、Na+、OH-、NO3- |
| C、Mg2+、Ca2+、Cl-、NO3- |
| D、K+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制水泥和玻璃都用石灰石做原料 |
| B、利用Al2O3制作的坩埚,可用于熔融烧碱 |
| C、Si可用做太阳能电池和光导纤维的材料 |
| D、铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、阿司匹林(主要成分:)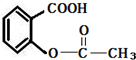 |
| B、胃舒平[主要成分:Al(OH)3] |
| C、碳酸氢钠片(主要成分:NaHCO3) |
| D、胃得乐(主要成分:MgCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
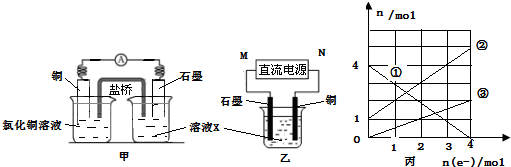
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com