
| A、铝单质与NaOH溶液反应:2Al+2OH-=2AlO2-+3H2↑ |
| B、醋酸溶液与NaHCO3溶液反应:H++HCO3-=CO2↑+H2O |
| C、SO2通入溴水中:SO2+Br2+H2O=SO42-+2Br-+2H+ |
| D、铁溶于过量稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O |


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
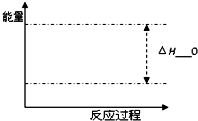 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.| 时间 物质 | 0min | 10min | 30min | 60min | 70min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝、镓合金与水反应后的物质可以回收利用冶炼铝 |
| B、铝的金属性比镓强 |
| C、铝镓合金的熔点比铝低 |
| D、Ga(OH)3与Al(OH)3性质相似,能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以葡萄糖为燃料的微生物燃料电池如图所示.关于该电池的叙述正确的是( )
以葡萄糖为燃料的微生物燃料电池如图所示.关于该电池的叙述正确的是( )| A、该电池能够在高温下工作 |
| B、电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| C、放电过程中,将生成的CO2和水随时排出,保持电解质浓度恒定 |
| D、在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO222.4/6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Na+、AlO2─、HCO3─ |
| B、Ba2+、NH4+、CO32-、Cl─ |
| C、K+、Fe2+、OH─、SO32─ |
| D、Na+、Ba2+、OH─、NO3─ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②⑥ |
| B、只有②⑤ |
| C、只有①②⑤⑥ |
| D、只有②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸 |
| B、向某溶液中滴入稀盐酸与氯化钡的混合溶液,检验该溶液中是否含有SO42- |
| C、将颗粒大小相同的钠与钾分别与水反应,比较钠、钾金属活泼性的强弱 |
| D、将Mg(OH)2和Al(OH)3分别与过量NaOH溶液反应,比较其碱性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol/LAlCl3溶液,含有Al3+的数目为NA |
| B、标准状况下,22.4LCCl4中分子数目为NA |
| C、0.1mol Fe与过量的稀硫酸充分反应,转移的电子数为0.3 NA |
| D、O2和O3组成的48g混合气体中含有3 NA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com