
| A. | 0.075mol/L | B. | 0.1125mol/L | C. | 0.15mol/L | D. | 0.225mol/L |
分析 根据反应3Cu+2NO3-+8H+=3Cu2++2NO+4H2O先判断过量,再进行计算解答.
解答 解:在某100mL混酸中,硝酸的物质的量n(HNO3)=0.1L×0.4mol/L=0.04mol,硫酸的物质的量n(H2SO4)=0.1L×0.2moL/L=0.02moL,
所以氢离子的物质的量n(H+)=0.02moL+0.01moL=0.03mol,
铜粉的物质的量=$\frac{0.96g}{64g/mol}$=0.015mol,依据方程式:
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
3 2 8
0.015mol 0.02mol 0.03mol
可知氢离子不足,故根据H+计算,由方程式可知n(Cu2+)=$\frac{3}{8}$×0.03mol=0.01125mol,
所以C(Cu2+)=$\frac{0.01125mol}{0.1L}$=0.1125mol/L,
故选:B.
点评 本题考查了硝酸的相关计算,题目难度不大,解题时注意依据离子反应方程式计算解.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
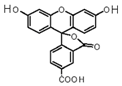 2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )| A. | 可与碳酸氢钠溶液反应 | |
| B. | 分子式为C21H12O7 | |
| C. | 1mol 该物质与足量NaOH溶液反应,可消耗4 mol氢氧化钠 | |
| D. | 不与FeCl3发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 实际应用 |
| A | 活性炭可吸附水中的悬浮物 | 用于自来水的杀菌消毒 |
| B | SO2具有还原性 | 漂白纸浆 |
| C | 铁被氧气氧化时会放出热量 | 铁、活性炭、无机盐、水等的混合物制成暖宝贴 |
| D | 氧化铝是两性氧化物 | 作耐高温材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素有浓度、压强、温度和催化剂 | |
| C. | 可逆反应达到化学平衡时,正、逆反应的速率都不为0 | |
| D. | 增大反应物浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 世博会期间,利用可降解的“玉米翅料”替代一次性饭盒,可防止产生白色污染 | |
| B. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 | |
| C. | 利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” | |
| D. | 高纯度的硅单质广泛用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
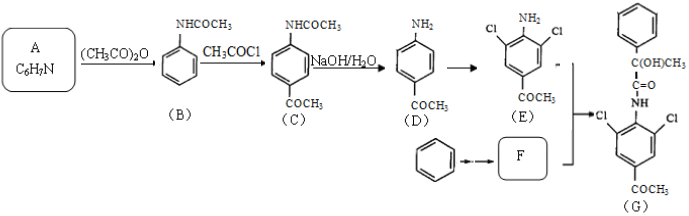 已知:
已知: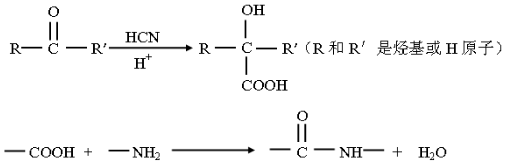
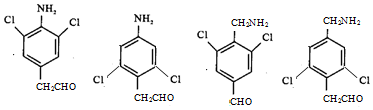
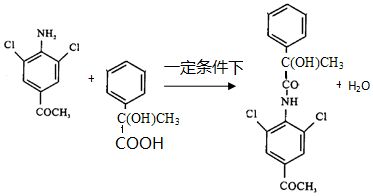
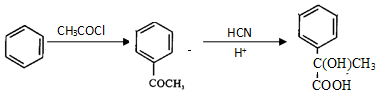 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
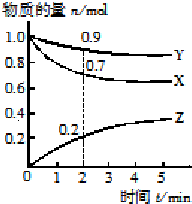 (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4mol HCl的浓盐酸与足量MnO2混合加热,转移电子数为2NA | |
| B. | 6.4gCu与过量硫粉反应,转移电子数为0.2NA | |
| C. | 通常状况下,112mL水中含有的电子数约为62.2NA | |
| D. | 标况下,2.24LSO3中含有0.1NA个SO3分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com