
| ||
| ||


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验装置保温、隔热效果差 |
| B、量取NaOH溶液的体积时仰视读数 |
| C、分多次把NaOH溶液倒入盛有硫酸的小烧杯中 |
| D、用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
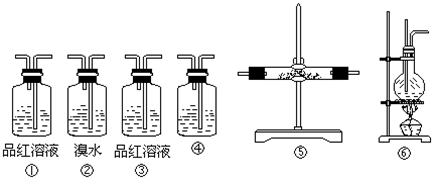
查看答案和解析>>
科目:高中化学 来源: 题型:
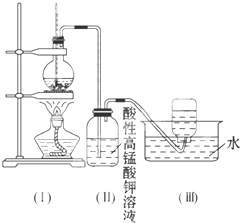 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯:CH3CH2OH
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯:CH3CH2OH| 浓硫酸 |
| ℃170 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用于熔化烧碱的坩埚,可用Al2O3这种材料制成 |
| B、铝能在空气中稳定存在是因为其表面覆盖着一层氧化铝薄膜 |
| C、氧化铝是一种难熔物质,是一种较好的耐火材料 |
| D、氧化铝能中和胃酸,可用于制胃药 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓ |
| B、向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| C、向Ba(OH)2溶液中加入过量的NaHCO3:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- |
| D、足量Cl2通入1.0mol?L-1 Na2SO3溶液中:2SO32-+Cl2=2S↓+2ClO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com