
【题目】毒奶粉事件曾一度震惊全国,主要是奶粉中含有有毒的三聚氰胺。下列关于三聚氰胺分子的说法中正确的是( )

A. 所有氮原子均采取sp3杂化
B. 一个三聚氰胺分子中共含有15个σ键
C. 三聚氰胺的分子式为C3N3H6
D. 三聚氰胺分子中同时含有极性键和非极性键
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种短周期元素的原子序数逐渐增大。A为非金属元素,且A、E同主族,C、D为同周期的相邻元素。E原子的质子数等于C、D原子最外层电子数之和。B原子最外层电子数是内层电子数的2倍。C的氢化物分子中有3个共价键,试推断:
(1)写出B元素在周期表中的位置____________________;
(2)由A、C、D所形成的离子化合物是_______________(填化学式),所含化学键类型为_____________,它与E的最高价氧化物对应水化物的溶液加热时反应的离子方程式是___________________________。
(3) C单质的电子式为____________________。
(4) B和D相比,非金属性较强的是_________________(用元素符号表示),下列事实能证明这一结论的是________________(选填字母序号)。
a.常温下,B的单质呈固态,D的单质呈气态 b.D的氢化物的稳定性强于B的氢化物
c.B与D形成的化合物中,B呈正价 d.D的氢化物的沸点高于B的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为MnO2和浓盐酸共热制取氯气的实验装置,反应为:MnO2+4HCl![]() MnCl2+Cl2+2H2O,请回答下列问题:
MnCl2+Cl2+2H2O,请回答下列问题:

(1)打开活塞K,将分液漏斗中的液体加入烧瓶中,观察D中导管口是否有气泡产生,__(填:能或不能)验证装置的气密性良好;
(2)C中收集到的Cl2中含有HCl,请从分子结构的角度解释其中的原因___;
(3)装置D的作用是___;
(4)B的作用为___(选填下列编号)。
A.洗气瓶 B.储气瓶 C.安全瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
I.采样
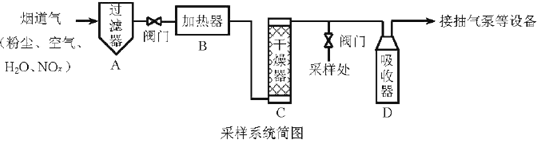
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140。C;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
II. NOx含量的测定
将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3-,加水稀释至100.00 mL。量取20.00 mL该溶液,加入V1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
(1)NO被H2O2氧化为NO3-的离子方程式是___________。
(2)滴定操作使用的玻璃仪器主要有___________。
(3)滴定过程中发生下列反应:
3Fe2+ +NO3-+4H+ = NO↑+3Fe3+ +2H2O
Cr2O72-+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为_________mg·m-3。
(4)判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若缺少采样步骤③,会使测试结果___________。若FeSO4标准溶液部分变质,会使测定结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )

A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
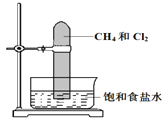
A. 试管中气体的黄绿色逐渐变浅,水面上升
B. 生成物只有三氯甲烷和氯化氢在标准状况下是气体
C. 试管内壁有油状液滴形成
D. 试管内有少量白雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是制备烯烃的常用方法,实验室制备环己烯的反应和实验装置如图所示.可能用到的有关数据如下:

相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.反应粗产物倒入f容器中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯.回答下列问题:
(1)由环己醇制取环己烯的方程式_________________;
(2)装置b的冷凝水方向是________________(填“下进上出”或“上进下出”);
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___(选答案);
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称及反应类型为_____、____;
(5)在分离提纯中,使用到的仪器f名称是___________;
(6)合成过程中加入浓硫酸的作用是_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常将酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
(1)配平以下离子方程式,并在横线及方框中填上所需的系数及微粒。
__H++__MnO4-+__H2C2O4→__CO2↑+__Mn2++__,___
(2)该反应中的还原剂是___。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为___mol。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的离子方程式是___。
②溶解沉淀时___(能或不能)用稀盐酸,原因是___。
③若滴定至终点时共消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则该血液中含钙___g/100mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com