
| A. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| C. | 在加热条件下发生的反应均为吸热反应 | |
| D. | 物质发生化学反应时不一定都伴随着能量变化 |
分析 A.反应热与反应物和生成物的状态有关,与反应条件无关;
B.等质量的硫蒸气具有的能量比硫固体多;
C.吸热反应不一定需要加热热才发生,加热才能发生的反应不一定是吸热反应;
D.化学反应的过程是旧键断裂新键形成的过程,断键成键都有能量变化.
解答 解:A.反应热与反应物和生成物的状态有关,与反应条件无关,同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,故A正确;
B.等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,故B错误;
C.吸热反应不一定需要加热热才发生,如氯化铵和氢氧化钡晶体的反应就是吸热的,加热才能发生的反应不一定是吸热反应,如铝热反应,故C错误;
D.化学反应的过程是旧键断裂新键形成的过程,断键成键都有能量变化,故D错误;
故选A.
点评 本题考查了吸热反应和放热反应,难度不大,注意所有化学反应都伴随着能量的变化,反应热与反应条件无关.


科目:高中化学 来源: 题型:解答题
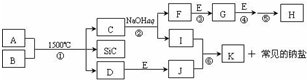 如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.
如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.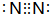 ,G的化学式NO;
,G的化学式NO;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的表面都电镀上一层耐腐蚀的黄金 | |
| B. | 环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去 | |
| C. | 铜的金属活动性比氢小,因此不易被氧化 | |
| D. | 它们是含一定比例金、银、锡、锌的铜合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象或事实 | 解释 | |
| A | 进行中和热测定时,将NaOH溶液一次性快速倒入盛有H2SO4的量热计中 | 减少热量散失,减少测量误差 |
| B | 加热滴有酚酞试剂的纯碱溶液,溶液红色变深 | 加热促进水的电离,溶液的碱性增强 |
| C | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀 | 生产的Al(OH)3胶体粒子带正电荷,发生定向移动 |
| D | 用FeCl3溶液制作印刷线路板 | FeCl3能从含有Cu2+的溶液中置换出Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
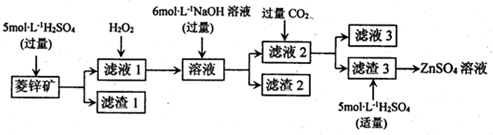
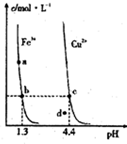 ②常温下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH.金属阳离子浓度的变化如图所示,下列判断正确的是BC.
②常温下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH.金属阳离子浓度的变化如图所示,下列判断正确的是BC.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g N20含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L N2含有的分子数目为NA | |
| C. | lmol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | 1L lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com