
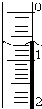
 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
分析 I.(1)溶液的稀释在烧杯中进行,溶液的定容在对应体积的容量瓶中进行;
(2)强碱滴定弱酸时应选择碱性变色范围内的指示剂酚酞;
(3)根据碱溶液应盛放在碱式滴定管中;根据滴定管的结构与精确度来分析;
(4)滴定终点时如溶液发生变化,并在半分钟内不变色;
Ⅲ.(1)根据数据的合理性求出平均消耗的NaOH溶液的体积,然后根据白醋与NaOH 溶液反应的关系式来解答;
(2)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
解答 解:I.(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液,
故答案为:100mL容量瓶;
(2)食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂酚酞,
故答案为:酚酞;
(3)NaOH 溶液应盛放在碱式滴定管中;滴定管液面的读数0.70mL;
故答案为:碱式滴定管;0.70;
(4)NaOH滴定食醋,滴定前溶液为无色,终点时溶液为红色,所以滴定的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色;
故答案为:溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅲ.(1)第1次滴定误差明显大,应舍去,其他3次消耗的NaOH溶液的体积的平均值为15.00mL;
设10mL市售白醋样品含有 CH3COOOH Xg,则
CH3COOOH~NaOH
60 40
Xg×0.2 0.1000mol/L×0.015L×40g/mol
X=0.450
样品总酸量$\frac{0.450g}{0.01L}$=4.5g/100mL,
故答案为:4.5;
(2)a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(待测)偏大,故a正确;
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(待测)偏大,故b正确;
c.锥形瓶中加入待测溶液后,再加少水,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(待测)不变,故c错误;
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(待测)偏小,故d正确;
故选:ab.
点评 本题以测定市售白醋的总酸量考查了中和滴定操作,误差分析以及化学计算,难度不大,只要掌握对应知识即可完成.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
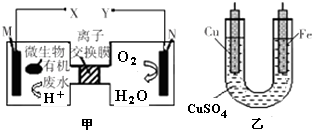
| A. | 铜电极应与X相连接 | |
| B. | H+透过离子交换膜由N极向M极移动 | |
| C. | M电极反应式:(C6H10O5)n+7n H2O-24n e-═6n CO2↑+24n H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
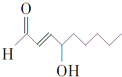 食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185℃)时,会产生如图所示高毒性物质,许多疾病和这种有毒物质有关,如帕金森症.下列关于这种有毒物质的判断正确的是( )
食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185℃)时,会产生如图所示高毒性物质,许多疾病和这种有毒物质有关,如帕金森症.下列关于这种有毒物质的判断正确的是( )| A. | 该物质分子中含有两种官能团 | |
| B. | 该物质的分子式为C9H15O2 | |
| C. | 1mol该物质最多可以和2molH2发生加成反应 | |
| D. | 该物质不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碱金属元素的阳离子随核电荷数增加,氧化性渐弱而还原性渐强 | |
| B. | 碱金属元素的原子半径越大,越易失电子,其单质还原性越强 | |
| C. | 随核电荷数增多,碱金属单质的熔点一定渐低,密度一定渐大 | |
| D. | 碱金属单质的金属性强,均易与Cl2、O2、N2等发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
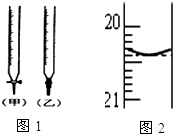 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前需要检查滴定管是否漏水 | |
| B. | 用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶 | |
| C. | 滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,会使滴定结果偏高 | |
| D. | 用已知浓度盐酸滴定未知浓度的NaOH溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | CaCO3/mol | CaO/mol | CO2/mol |
| A | 0.02 | 0.02 | 0.05 |
| B | 0.02 | 0.02 | 0.03 |
| C | 0.02 | 0.02 | 0.01 |
| D | 0.02 | 0 | 0.05 |
| E | 0.02 | 0.02 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 同价态氧化物的沸点:Z>X | |
| B. | 单质的氧化性:W>Z | |
| C. | Y和W可以同时存在于同一离子化合物中 | |
| D. | 它们都只能形成一种气态氢化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com