
【题目】下列说法不正确的是( )
A. 三聚氰酸(C3H3N3O3)的结构式为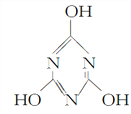 ,它属于共价化合物
,它属于共价化合物
B. 只含H、N、O三种元素的化合物,可能是离子化合物,也可能是共价化合物
C. NaHCO3、CH3COONa均含有离子键和共价键
D. 化合物MgO、H2O中化学键的类型相同
科目:高中化学 来源: 题型:
【题目】我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:
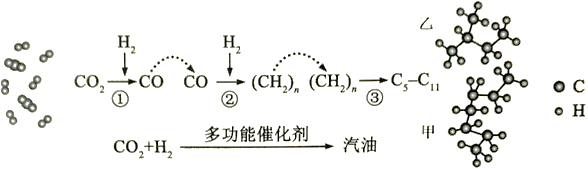
回答下列问题:
(1)二氧化碳分子中的化学键是_________________,物质乙的化学式是______________。
(2)写出反应①的化学方程式__________________________________。
(3)实验室常用纯净碳酸钙与稀盐酸反应制取二氧化碳气体,反应过程中产生二氧化碳的速率V(CO2) 与时间关系如下图:
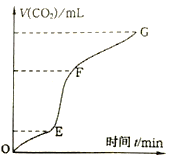
①由图像分析,化学反应速率最快一段是___________。
②为了增大上述化学反应的反应速率,欲向溶液中加入下列物质,你认为可行的是_________(填写序号)。
A.蒸馏水 B.氯化钠溶液 C.浓盐酸 D.加热
(4)二氧化碳能与氢氧化钠溶液反应,当氢氧化钠过量时反应生成碳酸钠,当氢氧化钠少量时反应生成碳酸氢钠。当二氧化碳与氢氧化钠反成的物质的量比为2:3时,溶液中的溶质是_______________。
(5)从原子结构角度说明氧原子得电子能力强于碳原子:___________________________________。
(6)在一定条件下,工业上也可用CO2合成甲醇(CH3OH),其化学方程式为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。 将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,t min时测得甲醇的物质的量为c mol。计算0-t min内CO2的反应速率为_________ mol·L-1·s-1。 [X 的反应速率ν(X)=X的物质的量浓度变化/变化需要的时间]
CH3OH(g)+H2O(g)。 将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,t min时测得甲醇的物质的量为c mol。计算0-t min内CO2的反应速率为_________ mol·L-1·s-1。 [X 的反应速率ν(X)=X的物质的量浓度变化/变化需要的时间]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中,能大量共存的离子组是( )
A. Na+、H+、SO42-、HCO3- B. Cu2+、K+、SO42-、NO3-
C. Na+、K+、Cl-、NO3- D. Ba2+、K+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
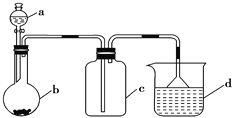
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀盐酸 | 锌粒 | H2 | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J为中学化学中常见的几种物质.它们有如图转化关系:常温下,A为生活中常见的无色无味液体,F、I为气体单质,B、D为常见金属,I分子中电子总数为34.H既能与酸反应,又能与碱反应.回答下列问题: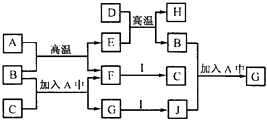
(1)写出下列物质的化学式:A , C;
(2)写出工业上冶炼D的化学方程式:;
(3)写出E与氢碘酸发生氧化还原反应的离子方程式:
(4)证明G中含有B元素的方法是(写出操作、现象及结论)
(5)从J的水溶液中获取J的晶体,应首先向J的水溶液中通人C的原因是 , 然后的实验操作是、过滤、洗涤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业用石英砂做原料通过三个重要反应生产单质硅:
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJmol﹣1 ,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=﹣657.01kJmol﹣1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=﹣625.63kJmol﹣1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
A.2.43×104 kJ
B.2.35×104 kJ
C.2.23×104 kJ
D.2.14×104 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是( )
A. 已知工业合成氨的正反应方向放热,所以升温正反应速率降低,逆反应速率升高
B. 实验室用H2O2分解制备O2,加入MnO2后,反应速率明显加快
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验,请回答下列问题:
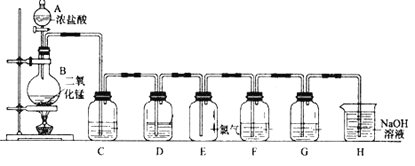
(1)仪器A的名称是____________。
(2)烧瓶中发生反应的化学方程式为(含条件)________________________。
(3)为在E装置中收集到干燥纯净的氯气,装置C中盛放的试剂为_____________(填写名称),作用是____________________________。
(4)F处盛有Na2S溶液,可用置换反应的原理证明氯的非金属性强于硫。反应的离子方程式为 _________________________________________。
(5)G中加入的是淀粉碘化钾溶液,发生反应的现象为_____________________________________。
(6)H为尾气处理装置,写出该装置中的离子方程式_________________________。有人认为,用NaOH溶液吸收尾气,可能会引起倒吸。下列装置中,能起到防倒吸作用的是_______(填序号字母)。

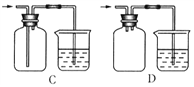
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com