
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.| 化学键 | C≡O | O=O | C=O |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
分析 (1)氧化还原反应中元素化合价升高的被氧化得到氧化产物;
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),与足量NaOH溶液混合发生酸碱中和反应生成盐和水;
(3)依据图表键能计算反应焓变,CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2 ,结合热化学方程式和盖斯定律计算③-②-3×①得到所需热化学方程式;
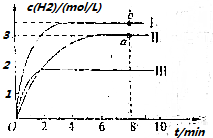
(4)①若曲线Ⅰ代表的是仅变化一种条件后的情况,曲线Ⅰ达到平衡所需时间少,说明反应速率快,且生成氢气浓度大,平衡正向进行,改变条件是升温;
②曲线Ⅱ对应反应的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,结合三行计算列式计算平衡浓度计算得到,若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,计算此时浓度商和平衡常数比较判断反应进行的方向;
③曲线Ⅲ相对于曲线Ⅱ,达到平衡所需时间短,反应速率快,氢气浓度减小说明平衡逆向进行.
解答 解:(1)Mg17Al12+17H2=17MgH2+12Al,此变化中镁元素化合价0价变化为+2价,被氧化得到氧化产物是MgH2,故答案为:MgH2;
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),与足量NaOH溶液混合发生酸碱中和反应生成盐和水,反应的化学方程式为:H2C2O4+2NaOH=Na2C2O4+2H2O,故答案为:H2C2O4+2NaOH=Na2C2O4+2H2O;
(3)CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2 =(958,5+$\frac{1}{2}$×497-2×745)KJ/mol=-282.9KJ/mol,
①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-282.9KJ/mol,
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
依据盖斯定律计算③-②-3×①得到CH4(g)+H2O(g)?CO(g)+3H2(g)△H=30.6KJ/mol,
故答案为:30.6KJ/mol;
(4)①若曲线Ⅰ代表的是仅变化一种条件后的情况,曲线Ⅰ达到平衡所需时间少,说明反应速率快,且生成氢气浓度大,平衡正向进行,改变条件是升温,a、b两点后,a点温度小于b点,所以用CO浓度变化表示的反应速率关系为a<b,
故答案为:升温;<;
②结合三行计算列式计算平衡浓度计算得到,图象中可知达到平衡状态氢气浓度为3mol/L,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 1.5 2 0 0
变化量(mol/L) 1 1 1 3
平衡量(mol/L) 0.5 1 1 3
曲线Ⅱ对应反应的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{{3}^{3}×1}{0.5×1}$=54,
若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,设物质的量浓度为c,计算此时浓度商Qc=$\frac{{c}^{3}×c}{c×c}$=c2,和平衡常数无法比较大小,所以反应进行方向无法确定,开始时H2的生成速率和氢气消耗数量无法确定,
故答案为:54;无法确定;
③曲线Ⅲ相对于曲线Ⅱ,达到平衡所需时间短,反应速率快,氢气浓度减小说明平衡逆向进行,
a.降低温度反应速率减小,达到平衡时间增大,故a错误;
b.使用催化剂加快反应速率、降低温度平衡逆向进行,氢气浓度减小,故b正确;
c.充入氦气总压增大,气体分压不变平衡不变,故c错误;
故答案为:b.
点评 本题考查了氧化还原反应、热化学方程式和盖斯定律计算应用、焓变的计算、反应速率和化学平衡影响因素分析判断、注意图象曲线变化的特征和化学平衡移动原理的理解应用,掌握基础是解题关键,题目难度中等.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 制单质氯:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ | |
| B. | 制单质镁:2Na+MgCl2$\frac{\underline{\;高温\;}}{\;}$2NaCl+Mg | |
| C. | 制聚氯乙烯:n CH2=CHCl $\stackrel{催化剂}{→}$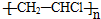 | |
| D. | 制纯碱:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有如图所示装置,为实现下列实验目的,其中Y端适合于作入口的是ABE.
有如图所示装置,为实现下列实验目的,其中Y端适合于作入口的是ABE.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
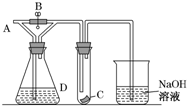 如图所示,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象,开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )
如图所示,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象,开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | Na2CO3溶液 | D. | 饱和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Cl2 | C. | HBr | D. | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.42 |
| Ⅲ | 0.00 | 19.92 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
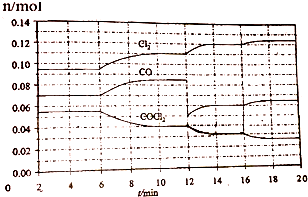
| A. | 1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率 | |
| B. | 若在6min时改变的条件为升高温度,则反应的平衡常数K增大 | |
| C. | 12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积 | |
| D. | 以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3] | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | c(ClO-)>c(HCO3-)>c(OH-) | |
| B. | c(Na+)=c(HCO3-)+c(CO32-)+c(ClO-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| C. | 在“催化剂对过氧化氢分解反应速率的影响”实验中,MnO2的用量以及颗粒直径的大小均会影响H2O2分解的速率,溶液的酸碱性对H2O2的稳定性也有较大的影响 | |
| D. | 在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com