
 蒸馏是提纯或分离
蒸馏是提纯或分离| 2 |
| 3 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| OH- |
| H+ |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |

查看答案和解析>>
科目:高中化学 来源: 题型:
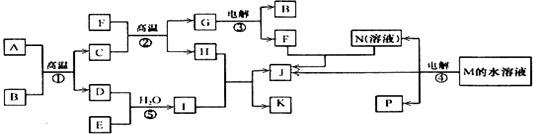
| B |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 | |
| A | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
| B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
| D | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鱼胆弄破后会使鱼肉粘上难溶于水的胆汁酸(一种酸)而变苦,要减少这种苦味可加入Na2CO3进行洗涤 |
| B、在制作腊肉可加入少量亚硝酸钠作发色剂和防腐剂 |
| C、把鱿鱼等海鲜浸泡在质量分数为40%的甲醛溶液中防腐保鲜 |
| D、炸油条时,常加入一些明矾和小苏打作疏松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液1 mL稀释至100 mL后,pH小于3 |
| B、向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 |
| C、该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 |
| D、该溶液中水电离出c(H+)是pH为3的硝酸中水电离出c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0△S>0 |
| B、△H<0△S<0 |
| C、△H<0△S>0 |
| D、△H>0△S<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com