
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
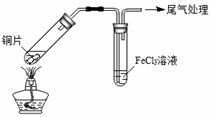
A B
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
| 步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是 。写出装置A中产生SO2的化学方程式: 。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因: 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式: 。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
| 步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为 。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
科目:高中化学 来源: 题型:
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第ⅤA族,甲和丙位于同一主族,丁原子的最外层电子数与电子层数相等。下列判断正确的是( )
A.原子半径:丙>乙>丁
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙).丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24.下列判断正确的是( )

|
| A. | 元素甲的简单气态氢化物稳定性比乙的强 |
|
| B. | 元素乙在周期表中的位置为第2周期,VIA族 |
|
| C. | 元素丙和元素丁的最高价氧化物对应的水化物均为强酸 |
|
| D. | 4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
N2(g)+3H2(g) 2NH3(g) △H<0。当反应达到平衡时,下列措施能提高N2转化率的是
2NH3(g) △H<0。当反应达到平衡时,下列措施能提高N2转化率的是
① 降温 ② 恒压通入惰性气体 ③ 增加N2的浓度 ④ 加压
A.①④ B.①② C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO和H2合成CH3OH:CO(g)+2H2(g)  CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
A.该反应的△H > 0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用5 ×103 kPa和250℃的条件,其原因是原料气的转化率高
D. t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,
则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.化学反应中的能量变化,只表现为热量的变化
B.煤和石油属于可再生能源
C.汽车排出大量尾气中含有CO会污染大气
D.要使燃料燃烧只需要大量的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol
B.H2(g)+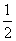 O2(g) == H2O(1) △H= ―285.8kJ/mol
O2(g) == H2O(1) △H= ―285.8kJ/mol
C.2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D.2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两只试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是____________________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH______1(选填“>”、“<”或“=”);乙方案中,说明HA是弱电解质的现象是_______。
a.装HCl 溶液的试管中放出H2的速率快
溶液的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两只试管中产生气体速率一样快
(3)请你评价:乙方案中难以实现之处或不妥之处_________________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述:___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关有机化合物的认识不正确的是( )
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的—CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com