
| A. | v(W)=v(Z) | B. | 2v(X)=3v(Z) | C. | v(X)=2v(Y) | D. | 3v(W)=2v(X) |
科目:高中化学 来源: 题型:选择题
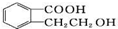 的有机物可以通过不同的反应得到下列四种物质
的有机物可以通过不同的反应得到下列四种物质 ②
② ③
③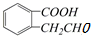 ④
④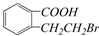 ,
,| A. | 取代反应、消去反应、酯化反应、加成反应 | |
| B. | 取代反应、消去反应、氧化反应、取代反应 | |
| C. | 酯化反应、取代反应、缩聚反应、取代反应 | |
| D. | 酯化反应、消去反应、取代反应、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | VA═0.5mol L-1S-1 | B. | VB═0.3mol L-1S-1 | ||
| C. | VC═4.8mol L-1min-1 | D. | VD═1mol L-1S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将58.5 g NaCl溶于1 L水中可得1 mol•L-1的NaCl溶液 | |
| B. | 从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| C. | 中和100 mL 1 mol/L的H2SO4溶液生成正盐,需NaOH 4 g | |
| D. | 将78 g Na2O2溶于水,配成1 L溶液可得到浓度为1 mol•L-1溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO4 2- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
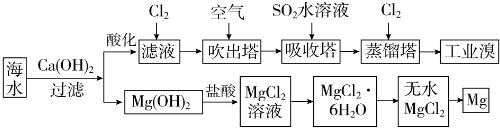
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
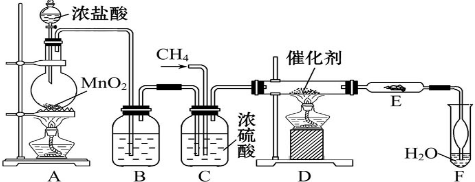
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 1mol (NH4)2Fe(SO4)2•6H2O晶体中含有离子总数为5NA | |
| C. | 常温常压下,2.24 L SO2和O2的混合气体中含有的氧原子总数为0.2 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中含的CO32-和HCO3-总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol/L | B. | 0.225 mol/L | C. | 0.35 mol/L | D. | 0.45 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com