
 原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:
原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:分析 原子序数小于36的X、Y、Z、W四种元素,其中X是形成的单质是最轻的物质,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;W的原子序数为29,则W是Cu元素.
解答 解:原子序数小于36的X、Y、Z、W四种元素,其中X是形成的单质是最轻的物质,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;W的原子序数为29,则W是Cu元素.
(1)Y2X2是乙炔,分子式为C2H2,碳氢原子之间存在σ键,碳碳三键中含有一个σ键,所以每个碳原子含有2个σ键,采取sp杂化,一个乙炔分子中含有3个σ键,所以1mol Y2X2含有σ键3×6.02×1023个,
故答案为:sp杂化;3×6.02×1023;
(2)CO2和N2O的原子个数相等、价电子数相等,所以是等电子体,故答案为:N2O;
(3)Z 的简单氢化物为氨气,Z 的最高价氧化物的水化物稀溶液为稀硝酸,标准状况2.24L 氨气为0.1mol,溶液稀硝酸放热Q kJ,则1mol氨气反应放出热量为10Q kJ,该反应的热化学方程式为:NH3(g)+HNO3(aq)=NH4NO3(aq)△H=-10Q kJ/mol,
故答案为:NH3(g)+HNO3(aq)=NH4NO3(aq)△H=-10Q kJ/mol;
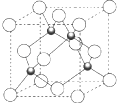
(4)利用均摊法知,该晶胞中黑色球个数=4,白色球个数=$\frac{1}{8}$=4,黑色球和白色球的个数之比=4:4=1:1,所以该物质的化学式是CuCl,它可与浓硝酸发生氧化还原反应,其反应方程式为:CuCl+NO3-+2H+=Cu2++Cl-+NO2↑+H2O,
故答案为:CuCl;CuCl+NO3-+2H+=Cu2++Cl-+NO2↑+H2O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、等电子体、热化学方程式、晶胞计算等知识点,(4)中注意利用氧化还原反应书写方程式.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
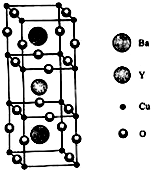 铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.
铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 给定条件的有机化合物 | 同分异构体数目 |
| A | 分子式为C4H9Cl的有机物 | 3种 |
| B | 分子式为C5H10O2的一元酯 | 8种 |
| C | 分子式为C5H10的环烷烃 | 3种 |
| D | 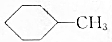 的一溴代物 的一溴代物 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
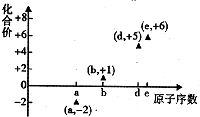 如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d属于同种核素 | B. | 第一电离能d>e,电负性d<e | ||
| C. | 气态氢化物的稳定性:a>d>e | D. | a和b形成的化合物不可能含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4 能与水缓慢反应生成Fe(OH)3 和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 太阳能、风能是可再生能源,应大力推广太阳能、风能的使用 | |
| D. | 新型能源生物柴油和矿物油的主要化学成分相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | C | CO | C2H6 | C2H5OH |
| 燃烧热/KJ•mol-1 | 393.5 | 283 | 1559.8 | 1366.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、蒸发 | B. | 萃取、蒸馏 | C. | 分液、蒸馏 | D. | 萃取、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
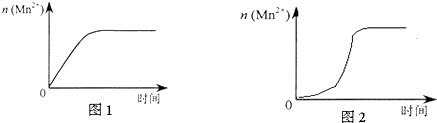
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 把t2℃时的MgSO4饱和溶液的温度升高,溶液仍然饱和 | |
| B. | 将t3℃时的MgSO4饱和溶液的温度降低,有晶体析出 | |
| C. | t2℃时,饱和溶液的溶质物质的量浓度:MgSO4比NaCl大 | |
| D. | 分别将t1℃时MgSO4饱和溶液、NaCl饱和溶液的温度升高到t2℃,所得溶液的溶质质量分数前者更大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com