
| A. | 简单氢化物的沸点:Y>R | |
| B. | 原子半径的大小顺序:Z>R>X>Y | |
| C. | 氧化物对应的水化物的酸性:R>X | |
| D. | 只含有Y、Z、R三种元素的化合物一定既含离子键又含共价键 |
分析 X、Y、Z、R均是短周期主族元素,X元素的一种核素可用于考古断代,X为C;Y元素原子中最外层电子数是次外层电子数的三倍,只有2个电子层符合电子排布规律,则最外层电子数为6,Y为O;Z元素化合物的焰色反应呈黄色,Z为Na;R原子的核外电子数是X原子与Z原子的核外电子数之和,R的电子数为6+11=17,则R为Cl,以此来解答.
解答 解:由上述分析可知,X为C,Y为O,Z为Na,R为Cl,
A.非金属性O>Cl,则简单氢化物的沸点:Y>R,故A正确;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径的大小顺序:Z>R>X>Y,故B正确;
C.非金属性越强,对应最高价含氧酸的酸性越强,最高价氧化物对应水化物的酸性:R>X,不是最高价无此规律,如碳酸的酸性大于HClO的酸性,故C错误;
D.只含有Y、Z、R三种元素的化合物为NaClO或氯酸钠、高氯酸钠等,均含离子键、共价键,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、电子排布、电子数及焰色反应来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | Na+、Fe3+、Cl-、SCN- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “从沙滩到用户”,计算机芯片材料是指单质硅 | |
| B. | 从海水中提取物质不都通过化学反应才能实现 | |
| C. | 煤经过气化、液化等化学变化可转变为清洁燃料 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )
分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )| A. | 元素非金属性q>n>p | |
| B. | 原子半径的大小m>q>n>p | |
| C. | Q的溶液可以保存在细口玻璃试剂瓶 | |
| D. | n的氧化物的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
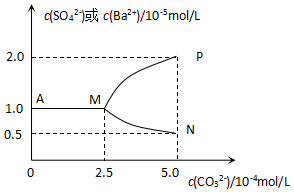 常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是| A. | 相同温度时,Ksp(BaSO4)>Ksp(BaCO3) | |
| B. | BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 | |
| C. | 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3 | |
| D. | 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(OH-)>c(Ba2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解后,电解槽底部的阳极泥中只有金属Pt | |
| B. | 电解过程中,电解质溶液的质量可能保持不变 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ | |
| D. | 阳极发生氧化反应,其电极反应式:Ni2++2e-═Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的NaOH溶于1L水中形成溶液的物质的量浓度为lmol•L-1 | |
| B. | 总质量为18g的H216O和H218O所含分子数为NA | |
| C. | 常温常压下,22.4L的CO2与Mg完全反应,转移电子数为4NA | |
| D. | 硫酸的摩尔质量与NA个硫酸分子的质量在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素镍(Ni)在溶液中+3价极不稳定,主要以Ni2+(绿色)、[Ni(NH3)6]2+(蓝色)、[Ni(CN)4]2-(橙黄色)、[Ni(CN)5]3-(深红色)等形式存在.Ni(OH)2为难溶于水的浅绿色固体.
元素镍(Ni)在溶液中+3价极不稳定,主要以Ni2+(绿色)、[Ni(NH3)6]2+(蓝色)、[Ni(CN)4]2-(橙黄色)、[Ni(CN)5]3-(深红色)等形式存在.Ni(OH)2为难溶于水的浅绿色固体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com