
| A. | 燃煤中加入CaO后可减少温室气体的排放量 | |
| B. | 糖类、油脂、蛋白质都是人类重要的营养物质,均属于天然高分子化合物 | |
| C. | 漂白粉、明矾均可用于饮用水处理,其化学原理相同 | |
| D. | 在全球每年被腐蚀的金属中,电化学腐蚀比化学腐蚀所占比例高 |
分析 A、加入氧化钙可与煤燃烧生成的二氧化硫在氧气中发生反应生成硫酸钙,二氧化硫排放量减少,但在高温下反应生成二氧化碳;
B、相对分子质量在10000以上的有机化合物为高分子化合物;
C、明矾中的铝离子在水中水解生成氢氧化铝胶体能吸附水中的悬浮颗粒,漂白粉有强氧化性能用于自来水的杀菌消毒;
D、根据金属的电化学腐蚀比化学腐蚀更常见;
解答 解:A、加入氧化钙可与煤燃烧生成的二氧化硫在氧气中发生反应生成硫酸钙,二氧化硫排放量减少,但在高温下反应生成二氧化碳,燃煤中加入CaO后可减少酸雨的发生,但不能减少温室气体的排放量,故A错误;
B、糖类中的单糖和二糖、油脂相对分子质量较小,不是高分子化合物,故B错误;
C、明矾中的铝离子在水中水解生成氢氧化铝胶体能吸附水中的悬浮颗粒,从而起到净水作用,但是明矾没有强氧化性不能杀菌消毒,而漂白粉有强氧化性能用于自来水的杀菌消毒,所以净水化学原理不同,故C错误;
D、因金属的电化学腐蚀比化学腐蚀更常见,所以电化学腐蚀比化学腐蚀所占比例高,故D正确;
故选D;
点评 本题考查了生活中的化学知识应用,物质的存在和分析判断,掌握基础是关键,题目较简单.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| B. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲乙两份混合物中均含Na2O20.16mol | |
| B. | 甲乙两份混合物中均含NaHCO30.02mol | |
| C. | 原混合物中Na2O2与NaHCO3物质的量之比无法确定 | |
| D. | 盐酸物质的量浓度可能为3.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
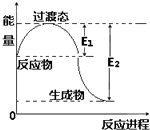 (1)如图为1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=134KJ/mol,E2=368KJ/mol( E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1、△H的变化分别是减小、不变(填“增大”、“减小”或“不变”).写出该反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(1)如图为1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=134KJ/mol,E2=368KJ/mol( E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1、△H的变化分别是减小、不变(填“增大”、“减小”或“不变”).写出该反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | 实验结论 |  | |
| A | 盐酸 | Na2S | 硫酸铜溶液 | 稳定性:HCl>H2S | |
| B | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 | |
| C | 浓硫酸 | C | 澄清石灰水 | 浓硫酸具有强氧化性 | |
| D | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

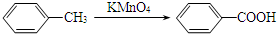
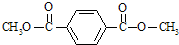 .
.
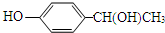 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | O2(PtF6)晶体中含有离子键 | |
| B. | O2(PtF6)中氧元素的化合价为+1价 | |
| C. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| D. | 反应中,每生成1mol O2(PtF6)转移1mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com