
| ||
| ||


科目:高中化学 来源: 题型:
| A、等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH |
| B、pH相同的溶液中:c(Na2CO3)<c(NaHCO3) |
| C、在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) |
| D、0.1mol?L-1 NaHS溶液中:c(Na+)=c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
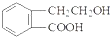 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 |
| B、除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 |
| C、可以用溴水鉴别乙醇、甲苯、四氯化碳、植物油 |
| D、只用银氨溶液就可以鉴别淀粉是否完全水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| B、酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2 +6H+═2Mn2++5O2↑+8H2O |
| C、等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ |
| D、铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com