
| A. | 实验室所制得的1.7gNH3中含有的电子数为0.1NA | |
| B. | 标准状况下2.24LHF中含有HF分子数为0.1NA | |
| C. | 1L0.1 mol•L-1NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 0.1mol氯酸钾与足量盐酸反应生成氯气转移电子数为0.5NA |
分析 A、求出氨气的物质的量,然后根据氨气中含10个电子来分析;
B、标况下HF为液体;
C、NaHSO4在溶液中能完全电离为钠离子、氢离子和硫酸根;
D、氯酸钾和盐酸的反应为归中反应,氯酸钾中的氯元素由+5价变为0价.
解答 解:A、1.7g氨气的物质的量为0.1mol,而氨气中含10个电子,故0.1mol氨气中含1mol电子即NA个,故A错误;
B、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、NaHSO4在溶液中能完全电离为钠离子、氢离子和硫酸根,且水也能电离出氢原子,故溶液中含有的阳离子的个数大于0.2NA个,故C错误;
D、氯酸钾和盐酸的反应为归中反应,氯酸钾中的氯元素由+5价变为0价,故0.1mol氯酸钾完全反应后转移0.5NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 生铁、普通钢和不锈钢中的碳含量依次增加 | |
| C. | 装修门窗使用的铝合金材料的硬度比铝大,熔点比铝低 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广“低碳经济”,减少温室气体的排放 | |
| B. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| D. | 关停化工企业,消除污染源头 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜溶于稀硝酸:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 三氯化铁溶液腐蚀印刷电路板:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 小苏打溶液中加足量澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
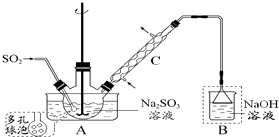 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
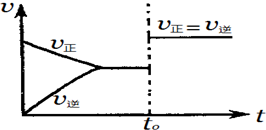
| A. | 若a+b=c,则t0时可能是增大反应体系的压强 | |
| B. | 若a+b=c,则t0时不可能是加入催化剂 | |
| C. | 若a+b≠c,则t0时只可能是加入催化剂 | |
| D. | 若a+b≠c,则t0时有可能是增大反应体系的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4分子呈正四面体形 | |
| B. | SiH4分子是非极性分子 | |
| C. | 因为Si-H键键能比C-H键键能低,所以SiH4沸点低于CH4沸点 | |
| D. | SiH4分子稳定性低于CH4分子,因为C-H键键能高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com