

| 10 |
| 4 |
| 3 |
| 2 |
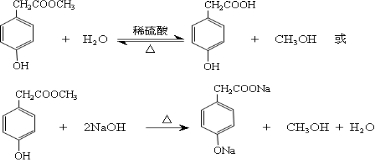 ,
, ;
; ,故答案为:
,故答案为: .
.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、化学平衡常数是一个比值,没有单位 |
| B、化学平衡常数是温度的函数,温度升高其值增大 |
| C、一个化学反应的平衡常数与物质的计量数无关 |
| D、对于同类型反应,化学平衡常数K的大小反映了化学反应可能进行的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| L/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| c2(Z) |
| c(X)?c(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 可用于制备一种重要的有机化工原料水杨酸
可用于制备一种重要的有机化工原料水杨酸 ,使用流程图表示其制备过程.(流程图示例:CH3CH2OH
,使用流程图表示其制备过程.(流程图示例:CH3CH2OH| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | ||
| Y | Z |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com