
【题目】取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出,试计算:
(1)原混合液中CO32﹣的物质的量浓度为 , Na+的物质的量浓度为 .
(2)产生的气体在标准状况下的体积L.
【答案】
(1)1mol/L;2.8mol/L
(2)11.2
【解析】解:(1)14.51克白色沉淀是BaCO3和BaSO4混合物,加入过量的稀HNO3 , 充分反应后,剩余沉淀4.66g为BaSO4 , BaSO4的物质的量为: ![]() =0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为:
=0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为: ![]() =0.4mol/L,减少的沉淀质量为BaCO3 , 故BaCO3的质量为14.51g﹣4.66g=9.85g,物质的量为:
=0.4mol/L,减少的沉淀质量为BaCO3 , 故BaCO3的质量为14.51g﹣4.66g=9.85g,物质的量为: ![]() =0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,所以Na2CO3的物质的量浓度为:
=0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,所以Na2CO3的物质的量浓度为: ![]() =1mol/L,
=1mol/L,
则原混合液中CO32﹣的物质的量浓度为:c(CO32﹣)=c(Na2CO3)=1mol/L;
Na+的物质的量浓度为:c(Na+)=2c(Na2CO3)+2c(Na2SO4)=1mol/L×2+0.4mol/L×2=2.8mol/L,
故答案为:1mol/L;2.8mol/L;(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3)=0.05mol,故生成的二氧化碳的体积为:0.05mol×22.4L/mol=1.12L,
故答案为:1.12.
(1)14.51克白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与硝酸,BaCO3溶于硝酸,故白色沉淀中加入过量的稀HNO3 , 充分反应后,沉淀减少到4.66g为BaSO4的质量,可得BaCO3的质量为14.51g﹣4.66g=9.85g,根据n= ![]() 计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,再根据c=
计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,再根据c= ![]() 计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度,最后分别计算出原混合液中碳酸根离子、钠离子的浓度;(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3),再根据V=nVm计算CO2的体积.
计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度,最后分别计算出原混合液中碳酸根离子、钠离子的浓度;(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3),再根据V=nVm计算CO2的体积.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,根据表中的①~⑩中元素,用相关的化学用语填空:
IA | 0 | |||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | ⅦA | |
2 | ⑩ | ② | ③ | ④ | ⑧ | |||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素⑩的名称是 , 从元素原子得失电子的角度看,元素④具有(填“氧化性”、“还原性”);比元素⑧质子数多16的元素在周期表中所处位置;
(2)⑥④⑦的氢化物稳定性由弱到强的顺序依次:(写氢化物的化学式);
(3)元素③的气态氢化物与其最高价氧化物的水化物反应的方程式为;
(4)写出元素⑤形成的单质在氧气中燃烧产物的电子式 , 这一反应是(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为;
(5)用电子式表示①与⑨反应得到的化合物的形成过程;
(6)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.HXR的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的主要内容之一是使原子充分利用,不产生污染物.下列化学反应符合“绿色化学”理念的是( )
A.制CuSO4:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.制CuSO4:2Cu+O2 ![]() 2CuO;CuO+H2SO4(稀)═CuSO4+H2O
2CuO;CuO+H2SO4(稀)═CuSO4+H2O
C.制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
D.制Cu(NO3)2:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定H2C2O4溶液,当_______时,滴定结束。
④记录数据,重复实验。整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)步骤①需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为__________________(填名称)。
(2)该反应原理的离子方程式为___________________________________;
(3)请将步骤③补充完整_________________________________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______mol/L,x=____________;
(5)若滴定终点读数时俯视液面,则x值会________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO47H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质.实验步骤如下: 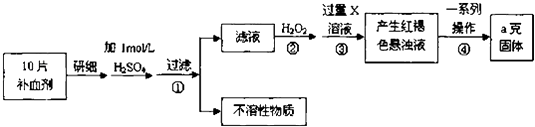
请回答下列问题:
(1)步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有(填离子符号),检验滤液中还存在Fe2+的方法为(注明试剂、现象).
(2)步骤②加入过量H2O2的目的是 .
(3)步骤③中反应的离子方程式为
(4)步骤④中一系列处理的操作步骤包括:过滤、、灼烧、、称量.
(5)若实验无损耗,则每片补血剂含铁元素的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2 LCO2所含的原子数为1.5NA
B.标准状况下,1 L水所含分子数为 ![]()
C.标准状况下,22.4 L H2中所含原子数为NA
D.常温常压下,48 g O3含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】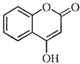 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
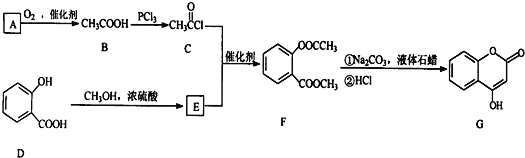
(1)已知A能与银氨溶液反应,写出A与银氨溶液反应的化学方程式____________________。
(2)B→C的反应类型是_________________反应。
(3)E的结构简式是______________________________。
(4)写出F和过量NOH溶液共热时反应的化学方程式:_________________________________。
(5)下列关于G的说法正确的是____________________。(填字母序号)
A.能与溴单质反应 B.能与金属钠反应
C.1molG最多能和3mol氢气反应 D.分子式是C9H7O3
E.一定条件下最多能和2mol NaOH溶液反应
(6)D的同分异构体中,满足加入FeCl3溶液显紫色且属于酯类的有______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com