
| a | |||||||
| d | f | g | |||||
| b | c | e | h | ||||
 .
.分析 由短周期元素在周期表中的位置可知,a为H、b为Na、c为Al、d为C、e为Si、f为N、g为O、h为Cl,
(1)g与b可形成离子化合物b2g为Na2O,属于离子化合物,由钠离子与氧离子构成;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
(3)计算氮气的浓度变化量,再计算氨气的浓度变化量,根据n=cV计算生成氨气;计算氢气的浓度变化量,根据速率公式计算v(氢气);
(4)a为H、d为C,X是最简单的有机物,则X为甲烷,甲烷和氧气反应生成水,反应热与化学计量数成正比;
(5)a为H、g为O,氢气、氧气构成的燃料电池,本质是氢气燃烧生成水,在反应中H2被氧化,O2被还原.H2应该在负极上反应,O2应该在正极上反应,又因为是碱性溶液,不可能有H+参加或生成.
解答 解:由短周期元素在周期表中的位置可知,a为H、b为Na、c为Al、d为C、e为Si、f为N、g为O、h为Cl,
(1)g与b可形成离子化合物b2g为Na2O,属于离子化合物,由钠离子与氧离子构成,电子式为: ,
,
故答案为: ;
;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性O>N>Si,非金属性越强,氢化物越稳定,故氢化物稳定性SiH4<NH3<H2O,
故答案为:SiH4<NH3<H2O;
(3)2min时,测得N2的浓度为0.75mol•L-1,则△c(N2)=$\frac{1mol}{1L}$-0.75mol/L=0.25mol/L,故△c(NH3)=2△c(N2)=0.5mol/L,则2min时NH3的物质的量=0.5mol/L×1L=0.5mol,△c(H2)=3△c(N2)=0.75mol/L,故v(H2)=$\frac{0.75mol/L}{2min}$=0.375mol/(L.min),
故答案为:0.5;0.375;
2△c(N2)=0.5mol/L,则2min时NH3的物质的量=0.5mol/L×1L=0.5mol,
(4)H元素和C元素可形成自然界最简单的有机物为CH4,常温常压下,4g该有机物完全燃烧可放出222.4kJ的热量,则1mol甲烷燃烧放出的热量为222.4kJ×$\frac{1mol×16g/mol}{4g}$=889.6kJ,甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)→CO2(g)+2H2O(1)H=-889.6kJ/mol,
故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(1)H=-889.6kJ/mol;
(5)a为H、g为O,氢气、氧气构成的燃料电池,本质是氢气燃烧生成水,电池总反应式为:2H2+O2=2H2O,碱性溶液,不可能有H+参加或生成,故负极的电极反应为H2-2e-+2OH-=2H2O,正极的电极反应为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-.
点评 本题考查元素周期表与元素周期律的综合应用,题目比较综合,涉及电子式、化学反应速率计算、乙烯性质、原电池等,难度中等,侧重对基础知识的巩固.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 三氯化铁溶液跟氨水反应:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ | |
| C. | 碳酸氢钙溶液跟稀硝酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| D. | 常温下将氯气通入氢氧化钠溶液:2Cl2+2OH-═3Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2,4二甲基-3-乙基己烷
2,4二甲基-3-乙基己烷查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
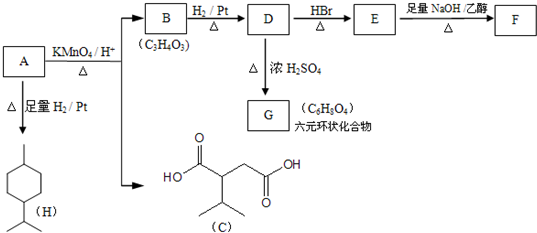
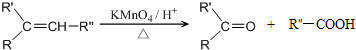
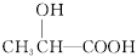 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +2H2O.
+2H2O.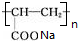 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com