
25 ℃时,KHS溶液里存在着下列平衡:
①HS-+H2O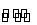 OH-+H2S
OH-+H2S
②HS-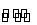 H++S2-
H++S2-
(1)_______是电离平 衡,________是水解平衡。
衡,________是水解平衡。
(2)当向其中加入CuSO4溶液时,生成了CuS沉淀,则电离平衡向________移动,水解平衡向_________移动,[H+]变________。(填“大”或“小”)
(3)当向其中加入NaOH固体时,[S2-]变_____________。(填“大”或“小”)
(4)若将溶液加热至沸腾,[OH-][H+]将变__________。(填“大”或“小”)
(1)①式HS-与H2O反应生成弱电解质H2S,是水解平衡;②式HS-电离成两种离子,故为电离平衡。
(2)当向其中加入CuSO4溶液时,生成了CuS沉淀,即溶液中[S2-]变小,②式平衡右移,导致[H+]增大,[HS-]降低,故①式左移。
(3)当向其中加入NaOH固体时,[OH-]增大,OH-中和H+,使②式平衡右移,[S2-]变大。
(4)若将溶液加热至沸腾,[OH-][H+]=Kw随温度升高而增大,故[OH-][H+]将变大。
答案:(1)② ①
(2)正反应方向 逆反应方向 大
(3)大
(4)大
【误区警示】弱酸酸式酸根离子的电离平衡容易与它的水解平衡混淆,应注意总结归纳、记忆、区分。
如HS-+H2O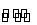 OH-+H2S,
OH-+H2S,
HS-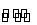 H++S2-
H++S2-
前者属于水解平衡,后者属于电离平衡;
HSO3-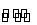 H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O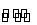 H2SO3+OH-
H2SO3+OH-
前者属于电离平衡,后者属于水解平衡;
HCO3-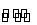 H++CO32-,HCO3-+ H2O
H++CO32-,HCO3-+ H2O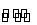 H2CO3+OH-
H2CO3+OH-
前者属于电离平衡,后者属于水解平衡等。


科目:高中化学 来源: 题型:
根据实验目的判断下列实验操作或装置正确的是( )
| 选项 | A | B | C | D |
| 目的 | 实验室制O2 | 配制稀硫酸溶液 | 在铁制品上镀铜 | 净化精制淀粉胶体 |
| 装置或操作 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中仅含有Na+、H+、CH3COO-、OH-四种离子,下列说法错误的是( )
A.溶液中四种离子之间可能满足:[Na+]>[OH-]>[H+]>[CH3COO-]
B.若溶液中离子浓度满足:[Na+]=[CH3COO-],则该溶液一定呈中性
C.若原溶质为CH3COONa,则:[Na+]> [CH3COO-]>[OH-]>[H+]
[CH3COO-]>[OH-]>[H+]
D.若溶液中离子浓度满足:[H+]>[OH-],则原溶液一定是CH3COOH和CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
A.a=b B.a>b
C.c(A-)=c(Na+) D.c(A-)<c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得两端导线中均通过0.02 mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
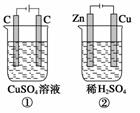
A.产生气体的体积:①>②
B.两极上析出物质的质量:②>①
C.溶液的pH变化:①增大,②减小
D.电极反应式①中阳极:4OH-—→2H2O+O2↑+4e-;②中阴极:2H++2e-—→H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
过渡金属催化的新型碳碳偶联反应是近年来有机合成的研究热点之一,如:
反应①
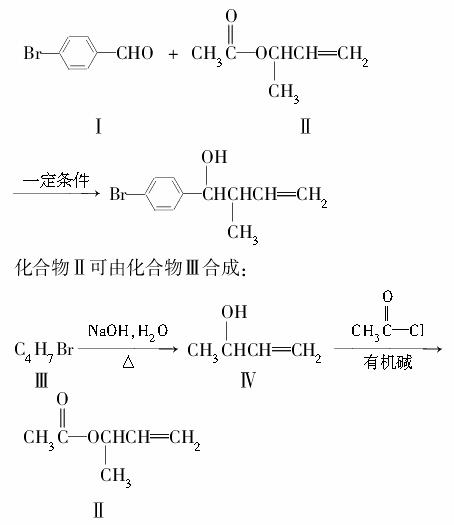
(1)化合物Ⅰ的分子式为________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为________。
(3)化合物Ⅲ的结构简式为________。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为____________________________(注明反应条件)。因此,在碱性条件下,由Ⅳ与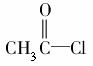 反应合成Ⅱ,其反应类型为________。
反应合成Ⅱ,其反应类型为________。
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应。Ⅴ与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为________(写出其中一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com