
 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
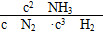 > ②c ③25% 0.05 mol/(L·min)
> ②c ③25% 0.05 mol/(L·min) 2Cu2O+N2↑+6H2O HN3
2Cu2O+N2↑+6H2O HN3 2NH3(g)
2NH3(g)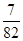 ,可得x=0.25,则N2的转化率为25%,
,可得x=0.25,则N2的转化率为25%,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B.标准状况下,28 g CO和22.4 L SO3所含分子数相等 |
| C.5.6 g铁粉与足量氯气充分反应,有0.2 mol电子转移 |
| D.等物质的量的CH5+和NH2—所含电子数相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA |
| B.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子总数等于0.1NA |
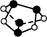
| D.0.5 mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S—S键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.贮存溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该温度和压强可能是标准状况 |
| B.标准状况下该纯净物若为气态,其体积约是22.4 L |
| C.该气体中每个分子含有2个原子 |
| D.若O2在该条件下为气态,则1 mol O2在该条件下的体积也为30 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA |
| B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA |
| C.常温常压下,20 g D2O含有的原子总数为3NA |
| D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.称取7.8 g Na2O2固体,放入250 mL烧杯中,用100 mL 量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL |
| C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D.用100 mL量筒量取40 mL 5 mol·L-1NaOH溶液,倒入250 mL烧杯中,再用另一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,22.4 L SO2和O2的混合气体中含有的氧原子数为2NA |
| B.标准状况下,22.4 L乙烯中含有共用电子对的数目为6NA |
| C.密闭容器中,3 mol H2和1 mol N2在高温、高压、催化剂的条件下充分反应后,容器内的气体分子总数为2NA |
| D.2.8 g的CO和2.8 g的N2所含质子数都为1.4NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.42 g C3H6中含有的共用电子对数目为9NA |
| B.电解饱和食盐水时,当0.1 mol NaCl反应时,转移的电子数为NA |
| C.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA |
| D.1 L 0.01 mol·L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com