
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为____________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是____________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:
____________________________________________________________ 。
⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式为___________________________。
⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2 ![]() Fe + 2ZG
Fe + 2ZG

放电时,电池的正极反应式为_______________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为___________________。
【答案】 第二周期VIA HClO4 H2S O3、Cl2、ClO2 2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l);△H=﹣2a kJ · mol-1 ![]()
![]() 2Na+FeCl2==Fe+2NaCl Na β-Al2O3
2Na+FeCl2==Fe+2NaCl Na β-Al2O3
【解析】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,X为主族元素,所以X是H元素;X、Z同主族,可形成离子化合物ZX,Y为主族元素,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体)。
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族;(2)非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4;非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是H2S;(3)Y的单质O3、G的单质Cl2、二者形成的ClO2,均具有强氧化性,可作消毒剂;(4)H2S的燃烧热△H=-a kJmol-1,根据燃烧热的含义,H2S燃烧的热化学方程式生成物应该生成SO2,故H2S燃烧反应的热化学方程式为:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-2akJmol-1;(5)ZX为NaH,属于离子化合物,由钠离子与氢负离子构成,电子式为![]() ;Na与水反应生成氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑;(6)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2
;Na与水反应生成氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑;(6)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2![]() Fe+2NaCl. 放电时为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为Fe2++2e-=Fe;充电时,为电解池,负极发生还原法,故Na电极接电源的负极,由电池结构可知,该电池的电解质为β-Al2O3。
Fe+2NaCl. 放电时为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为Fe2++2e-=Fe;充电时,为电解池,负极发生还原法,故Na电极接电源的负极,由电池结构可知,该电池的电解质为β-Al2O3。


科目:高中化学 来源: 题型:
【题目】在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,物质的量浓度为c mol·L-1,则下列选项不正确的是( )
A. 溶质的质量分数为w=![]()
B. 用水稀释该溶液,OH-的物质的量增加
C. 该溶液中共有6种微粒
D. 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA
B. 56gN2与CO混合物中原子总数是4NA
C. 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA
D. 常温下,lLpH=1的H2SO4溶液中的H+为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)某同学设计下图装置进行探究“铜和稀硝酸反应制取NO”的实验(夹持装置已略去),则制取NO的化学方程式为:____________;

利用该装置还可制取并收集少量其他气体,请完成下表:
制取气体 | 药品 |
O2 | __________ |
_______ | 某溶液_________________、Al |
(2)根据图1回答:
①打开K1,合上K2。则此时此装置为 ______;A电极可观察到的现象是____。
(3)根据图2回答:
将纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为_________________。
图2对应的实验完成后,铜电极增重6.4g,石墨电极产生标准状况下的气体体积_____L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)请你一起参与实验探究并回答下列问题:
Ⅰ.在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①_______________、
②_______________、
③________________。
II.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

⑴各装置连接顺序为_____ →_____ → _____ 。
⑵装置C中装有试剂的名称是_________________。
⑶能证明生成物中有CuCO3的实验现象是________________________。
Ⅲ.若蓝色沉淀中CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其中CuCO3组成:
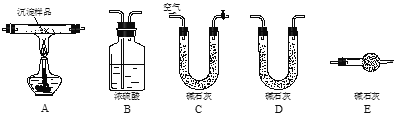
⑴ 实验开始时先要将空气通过碱石灰的目的是____________________;
实验中持续通入过量空气的作用是______________。
⑵若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是宝贵的自然资源,水的净化与污水处理是化学工作者需要研究的重要课题。
(1)在净水过程中用到混凝剂,其中不可以作为混凝剂使用的是__________。
A.硫酸铝 B.氧化铝 C.碱式氯化铝 D.氯化铁
(2)海水淡化是人类获得饮用水的一个重要方法,下列有关海水淡化处理的方法正确的是_____。
A.蒸馏法能耗最小,设备最简单;冷冻法要消耗大量能源
B.利用电渗析法淡化海水时,在阴极附近放阴离子交换膜,在阳极附近放阳离子交换膜
C.利用电渗析法淡化海水时,得到淡水的部分在中间区
D.利用反渗透技术可以大量、快速地生产淡水
(3)除了水资源,能源、信息、材料一起构成了现代文明的三大支柱。甲醇是一种重要的化工原料,以甲醇、氧气为基本反应物的新型燃料电池已经问世,其结构如图所示(甲醇解离产生的H+可以通过质子交换膜进入另一极)。请写出通入甲醇的电极上的电极反应式:____________。

某同学以甲醇燃料电池为电源,以石墨为电极电解500mL 0.2mol·L1 CuSO4溶液,则与电源正极相连的电解池电极上的电极反应式为:_______________________________;电解一段时间后,在电解池两极上共产生7.84 L气体(标准状况下),此时甲醇燃料电池中共消耗甲醇_________g 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com