
A.2Al+2NaOH+2H2O====2NaAlO2+3H2↑
B.2KMnO4+HCOOK+KOH====2K2MnO4+CO2↑+H2O
C.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.K2Cr2O7+6FeSO4+7H2SO4====Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
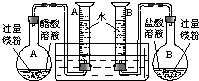 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.| A烧瓶中 | B烧瓶中 | 20℃、101kPa 50mL量筒内气体读数 |
反应时间 | |
| A瓶 | B瓶 | |||
| 40mL0.1mol/L 醋酸溶液 |
40mL0.1mol/L 盐酸溶液 |
5mL | t(a1)=155s | t(b1)=7s |
| 10mL | t(a2)=310s | t(b2)=16s | ||
| 15mL | t(a3)=465s | t(b3)=30s | ||
| 20mL | t(a4)=565s | t(b4)=64s | ||
| … | … | … | ||
| 44.8mL | t(an)=865s | t(bn)=464s | ||
查看答案和解析>>
科目:高中化学 来源: 题型:

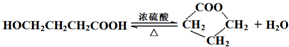







查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com