
碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下: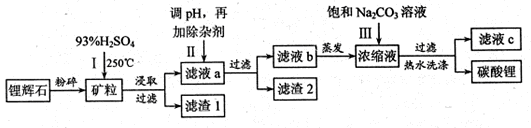
已知①2LiAlSi2O6+H2SO4 Li2SO4+Al2O3·4SiO2?H2O
Li2SO4+Al2O3·4SiO2?H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液PH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
(1)增大锂辉石与硫酸的接触面积,加快浸出反应速率,提高浸出率
(2)Al3+、Fe3+ CaCO3+2H+=Ca2++H2O+CO2↑ (3)2Fe2++H2O2+2H+=2Fe3++2H2O,
(4)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失 (5)Na2SO4
解析试题分析:(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒可以扩大与硫酸的接触面积,加快浸出反应速率,提高浸出率。(2)在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时因为Fe3+、Al3+完全形成氢氧化物沉淀时,溶液的PH分别为3.2、4.7,其它的PH值都大于 6.0—6.5。故此时沉淀的杂质离子有Al3+、Fe3+ 。石灰石调节溶液PH的原理的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑。(3)加入双氧水能把亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,其它的反应都是复分解反应。(4)根据表格中碳酸锂的溶解度与温度的关系可知:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失。(5)由于它们发生了复分解反应。所以从滤液c中可回收的主要物质是Na2SO4。
考点:考查碳酸锂的制法及应用的知识。


科目:高中化学 来源: 题型:填空题
孔雀石的主要成分为Cu2(OH)2CO3。某校化学兴趣小组的同学设计从孔雀石中冶炼铜的方案如下:
回答下列问题:
(1)在粉碎后的孔雀石中加入稀硫酸,观察到的现象是_______________。
反应的离子方程式是___________________________________________。
(2)操作a中用到的玻璃仪器是____________________________________。
(3)A的化学式为________,在悬浊液中加入A的目的是______________。
(4)操作b包括洗涤和低温烘干,作用是__________________________。
(5)有同学认为,利用铁屑和稀硫酸,不通过上述实验方案,也能从孔雀石中冶炼铜。请你用简洁的文字说明不同方案的实验原理__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是某企业设计的硫酸—磷肥—水泥联产、海水—淡水多用、盐—热—电联产的三大生态产业链流程图。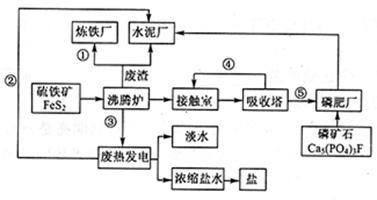
根据上述产业流程回答下列问题:
(1)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:① 、② 、③ 、④ 、⑤ 。
(2)沸腾炉发生反应的化学方程式: 。磷肥厂的主要产品是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙得化学方程式 。
(3)用1吨硫铁矿(FeS2的质量分数为36%)接触法制硫酸,制硫酸的产率为65%,则最后能生产出质量分数为98%的硫酸 吨。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据现代化工厂设计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。
, (写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是: ;可循环利用的物质是:_____________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。
(6)检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水 ④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钛合金是航天航空工业的重要材料。由钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO3)制备Ti等产品的一种工艺流程示意图如下:
已知:① TiO2+易水解,只能存在于强酸性溶液中。 ②常温下,难溶电解质溶解度与pH关系图。
③25 ℃时TiO(OH)2溶度积Ksp=1×10-29
回答下列问题:
(1)写出钛铁矿酸浸时,反应的离子方程式 。
(2)操作Ⅱ包含的具体操作方法有 。
(3)向“富含TiO2+溶液”中加入Na2CO3粉末的作用是 , TiO2+水解的离子方程式为 ,当溶液pH= 时,TiO(OH)2已沉淀完全。
(4)加入铁屑将Fe3+转化为Fe2+的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分
为钛酸亚铁( FeTiO3).其中一部分铁元素在风化过程中会转化为+3价。
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为____。
(2)步骤③中,实现混合物的分离是利用物质的____(填字母序号)。
a.熔沸点差异 b溶解性差异 c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是____(填操作名称)。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为
(5)利用下图装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还原剂,可还原二氧化钛制各金属钛。
①阳极所发生的反应为________。
②在制备金属钛前后,CaO的总量不变,其原因是____。
(6)_T业上用4.0吨钛铁矿制得1. 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是____。
(假设生产过程中钛没有损失)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。
已知:I.
Ti(s)+O2(g)=TiO2(s) △H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g) △H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
 TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因 查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于工业生产的说法中,错误的是( )。
| A.氯碱工业中的阳离子交换膜阻止阳离子通过 |
| B.生产普通玻璃的主要原料有石灰石、石英和纯碱 |
| C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极 |
| D.工业上,用焦炭在电炉中还原二氧化硅得到含少量杂质的粗硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com