
分析 (1)氯化铁和铜反应生成氯化亚铁和氯化铜,依据离子方程式书写方法写出;用KSCN溶液检验Fe3+的存在;
(2)过程Ⅰ加入铁屑的主要作用是和氯化铜发生反应生成铜,过滤后得到固体为Fe和Cu,加入盐酸铁反应,铜不反应过滤分离得到铜;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;
(4)过程Ⅱ中调节溶液的pH为,氢氧化铁沉淀溶液中存在沉淀溶解平衡,依据溶度积常数计算.
解答 解:(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;向溶液中加入KSCN溶液,若溶液变红,则证明混合物溶液仍存在Fe3+,故答案为:2Fe3++Cu=2Fe2++Cu2+;取少量反应后的溶液于洁净的试管中,向其中滴加KSCN溶液,若出现红色溶液,则证明仍存在Fe3+;
(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜,用盐酸溶解铁反应,铜不反应过滤得到铜,
故答案为:做还原剂,回收铜;加入盐酸反应后过滤;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;反应的化学方程式为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)过程Ⅱ中调节溶液的pH为5,常温下溶液中氢氧根离子浓度为10-9mol/L,依据溶度积常数计算铁离子浓度,Fe(OH)3(s)?Fe3++3OH-;Ksp=c(Fe3+)×c3(OH-);c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-9})^{3}}$=4×10-11mol/L;
故答案为:4×10-11mol/L.
点评 本题考查了铁离子的氧化性,提取铜的反应过程和步骤分析判断,氢氧化铁氢氧化亚铁的转化反应,溶度积的计算应用,题目难度中等.


科目:高中化学 来源: 题型:多选题
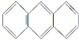 )和菲(
)和菲(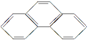 )都是比较简单的稠环芳香烃,有关它们的说法正确的是( )
)都是比较简单的稠环芳香烃,有关它们的说法正确的是( )| A. | 蒽和菲属于同系物 | |
| B. | 蒽和菲属于同分异构体 | |
| C. | 蒽的一氯代物有3种,而菲的一氯代物有5种 | |
| D. | 蒽和菲均可以看成是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2COOCH(CH3)2 | B. | CH3CH2COOCH2CH=CH2 | ||
| C. | (CH3)2CHCOOCH2CH(CH3)2 | D. | CH3CH2CH2COOCH2CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片加入到少量浓烧碱溶液中:Al+3OH-═Al(OH)3 | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀:2Al++6OH-+3SO42-+3Ba2+═2Al(OH)3↓+3BaSO4↓ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O | |
| D. | 用惰性电极电解 饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液变红色的溶液:NH4+、K+、I-、SO42- | |
| B. | 在pH=11的溶液中:Na+、AlO2-、NO3-、S2-、SO32- | |
| C. | 由水电离的c(OH-)=10-13mol•L-1的溶液中:Na+、Cl-、HCO3-、NO3- | |
| D. | 使甲基橙变红色的溶液:Fe2+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80mL 10mol•L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA | |
| B. | 2 L0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 标准状况下,11.2LSO3所含的分子数大于0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com