
【题目】三种常见元素结构信息如下表,试根据信息回答有关问题:
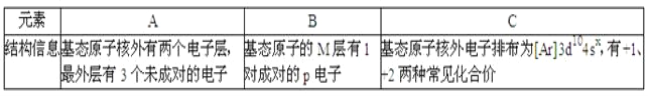
(1)写出B原子的基态电子排布式__;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键__(任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角__(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__,简要描述该配合物中化学键的成键情况__;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“”表示没有形成共价键的最外层电子,短线表示共价键.

在以上分子中,中心原子采用sp3杂化形成化学键是__(填写序号);在②的分子中有__个σ键和__个π键
【答案】1s22s22p63s23p4 N﹣H…N﹣或N﹣H…O﹣或 O﹣H…N﹣或O﹣H…O﹣ 变大 [Cu(NH3)4]SO4 中心原子与配体之间以配位键相结合,铜氨络离子与硫酸根离子之间以离子键相结合 ①③④ 3 2
【解析】
根据表中所给的信息,A基态原子有2个电子层,且最外层有3个未成对电子,则2p能级的3个轨道上分别有3个电子,即最外层有5个电子,为N元素;B基态原子,M层有1对成对电子,则3p能级有4个电子,为S元素;C基态原子核外电子排布及化合价可确定为Cu元素;
(1)B为S元素,其基态原子的核外电子排布式为:1s22s22p63s23p4;
(2)A为N元素,其氢化物为氨气,氨水中存在的氢键为:N﹣H![]() N﹣或N﹣H
N﹣或N﹣H![]() O﹣或O﹣H
O﹣或O﹣H![]() N﹣或O﹣H
N﹣或O﹣H![]() O﹣;孤电子对的排斥作用比成键电子对更强一些,氨气分子结合一个H+形成阳离子后,孤电子对转化为成键电子对,斥力减小,键角增大;
O﹣;孤电子对的排斥作用比成键电子对更强一些,氨气分子结合一个H+形成阳离子后,孤电子对转化为成键电子对,斥力减小,键角增大;
(3)向硫酸铜溶液中加入过量的氨水,则生成配合物,[Cu(NH3)4]SO4,中心原子Cu2+提供空轨道,氨分子给出孤电子对,以配位键形成[Cu(NH3)4]2+,再与SO42-以离子键结合;
(4)孤电子对数+中心原子的化学键个数为2,则sp杂化;为3,则sp2杂化;为4,则sp3杂化,答案为①③④;②的分子中有3个σ键和2个π键;答案为①③④;3;2


科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,4gH2、11.2LO2、1molH2O中,所含分子数最多的是__(写出化学式,下同),含原子数最多的是__,质量最大的是__,体积最小的是___。
(2)等质量的氧气和臭氧(O3),它们的物质的量之比为__,原子的个数之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)下列物质能导电且属于电解质的是_____(填序号)。
A.固态氯化镁(MgCl2) B.熔融氯化镁(MgCl2)
C.氯化钠溶液 D.铝
(2)写出下列物质在水溶液中的电离方程式:
①Na2CO3________;
②H2SO4__________;
③KHSO4_________。
(3)在下列反应中,HCl作还原剂的是_____,HCl作氧化剂的是____。
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示。下列叙述中正确的是
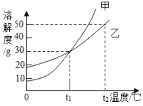
A.t1℃时,在100 g水中放入60 g甲,其溶质的质量分数为37. 5%
B.t1℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C.t2℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.t2℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中五种元素A,B,C,D,E原子序数依次增大,其中A,B,C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数.D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B,C,D,E四种元素的原子,半径从大到小的顺序是__(填元素符号或化学式,下同);第一电离能从大到小的顺序是__
(2)C原子的电子排布图__,D2﹣的结构示意图__.A,D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式__,分子中含有__键(填“极性”或“非极性”,下同)是__分子.
(3)A,B,D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式__,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为__杂化,空间构型为__.
(4)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为__,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于3 区域的( )

A.Cl2+2KBr = Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O =4Fe(OH)3
D.2Na2O2+2H2O =4NaOH+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中甲、乙、丙表示某动物细胞中的不同化合物,下列叙述正确的是( )

A. 核糖核苷酸是构成物质甲的基本单位
B. 物质甲为该生物的主要遗传物质
C. 物质丙是构成细胞的基本骨架
D. 物质乙的种类和数量与细胞膜的功能密切相关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应:
①若所含溶质的物质的量相等,则生成沉淀的物质的量之比是 _________ ;
②若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量之比是 _______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com