
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
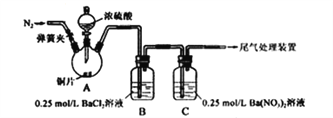
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________;
(2)C中生成白色沉淀的离子方程式为__________________;
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。为证实各自的观点,在原实验基础上,甲、乙两同学分别作了如下实验:甲在原有操作之前通N2,一段时间,B中产生大量白色沉淀。乙在A、B间增加盛放饱和NaHSO3溶液的洗气瓶,B中有少量白色沉淀。产生少量沉淀的原因是_____________。
(4)结合(3)中两同学的实验现象。你认为原实验B中产生大量白色沉淀的主要原因是_____________。
【答案】 Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+H2O 3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+ 2SO2+2Ba2++O2+2H2O=2BaSO4↓+4H+ 或系统中的氧气将SO2氧化生成SO42-与Ba2+反应生成BaSO4 酸雾与Ba2+反应生成沉淀或硫酸酸雾与Ba2+反应生成沉淀
CuSO4+SO2↑+H2O 3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+ 2SO2+2Ba2++O2+2H2O=2BaSO4↓+4H+ 或系统中的氧气将SO2氧化生成SO42-与Ba2+反应生成BaSO4 酸雾与Ba2+反应生成沉淀或硫酸酸雾与Ba2+反应生成沉淀
【解析】(1)铜和浓硫酸加热条件下生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)C中硝酸根离子在酸性条件下具有强氧化性,能将SO2氧化为SO42-,发生的反应的离子方程式是3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+,故答案为:3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+;
(3)空气中含有氧气,将反应生成的二氧化硫生成硫酸根,硫酸根与氯化钡反应生成硫酸钡沉淀,故答案为:空气中的氧气将铜与浓硫酸反应生成的二氧化硫氧化,生成硫酸根,硫酸根离子与钡离子反应生成硫酸钡沉淀;
(4)结合(3)中两同学的实验现象,BC中均有沉淀生成,说明硫酸酸雾与Ba2+反应生成沉淀,故答案为:硫酸酸雾与Ba2+反应生成沉淀。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】下列有关烷烃的叙述中,不正确的是
A. 在烷烃分子中,所有的化学键都为单键
B. 所有的烷烃在光照条件下都能与氯气发生取代反应
C. 烷烃分子的通式为CnH2n+2,符合该通式的烃不一定是烷烃
D. 随着碳原子的增加,烷烃的熔、沸点逐渐升高。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的实验现象及结论描述正确的是
A.钠在空气中燃烧发出黄色火焰,生成氧化钠
B.钠加入到CuSO4溶液中,有红色物质析出,即析出Cu单质
C.向CaCl2溶液中通入少量CO2气体,出现白色沉淀,即生成CaCO3固体
D.氢气在氯气中燃烧产生苍白色火焰,生成了HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验的叙述正确的是( )
A.用已知浓度的盐酸滴定未知浓度的氨水选用酚酞做指示剂
B.用待测液润洗滴定用的锥形瓶
C.Na2CO3溶液保存在带橡胶塞的试剂瓶中
D.配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家借助太阳能产生的电能和热能,用空气和水作原料合成了氨气.下列有关说法正确的是( )
A.该合成中所有的电能和热能全部转化为化学能
B.该合成氨过程不属于氮的固定
C.空气、水、太阳能均为可再生资源
D.断裂N2中的N≡N键会释放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:在B槽中装有100mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.6amL。
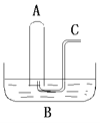
(1)将A倒插入B水槽中发生的反应为________________________________ ,该反应中氧化剂与还原剂的质量比为__________ ,原混合气体中NO2和NO的物质的量之比为________.
(2)通过导气管C往余下气体的试管A中缓慢持续通入氧气,A中可能观察到的现象是: __________.
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为_________ (设溶液的体积仍为100mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为-107. 3℃,沸点为12.5 ℃),且三氯化硼用于制取乙硼烷(B2H6)。某兴趣小组设计如图所示装置制备三氯化硼。

回答下列问题:
(1)装置D中发生反应的化学方程式为_____________________。
(2)装置B、E的作用分别是________________、________________。
(3)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(4)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),其理由是__________。
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实与原子结构模型建立的关系正确的是
A.阴极射线实验发现电子:道尔顿原子结构模型
B.α粒子散射实验发现原子核:卢瑟福原子结构模型
C.氢原子光谱发现电子分层排布:卢瑟福原子结构模型
D.α粒子散射实验发现电子:汤姆生原子结构模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能而成为当前生命科学的研究热点,NO亦被称为“明星分子”。回答下列问题:
(1)NO对环境的危害主要是_________。
A.破坏臭氧层 B.高温下能使一些金属被氧化
C.形成酸雨 D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:__________________________。
(3)常温下,在一个体积固定的容器里,把NO气体压缩到100个大气压。将容器中气体加热到50℃,发现气体的压强迅速下降,至略小于下降前压强的 ![]() 时就不再变化,已知其中一种产物为N2O ,写出上述变化的化学方程式:_______________。
时就不再变化,已知其中一种产物为N2O ,写出上述变化的化学方程式:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com