
| ŹµŃéŠņŗÅ | ĪĀ¶Č/”ę | Ń¹Ēæ/kPa | CH4³õŹ¼ÅضČ/mol•L-1 | H2O³õŹ¼ÅضČ/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
·ÖĪö £Ø1£©ŅŃÖŖ£ŗ¢ŁCH4£Øg£©+2O2£Øg£©=CO2£Øg£©+2H2O£Øg£©”÷H=-802.3kJ•mol-1£¬¢ŚH2O£Ø1£©=H2O£Øg£©”÷H=+44.0kJ•mol-1£¬øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł-¢Ś”Į2µĆ£ŗCH4£Øg£©+2O2£Øg£©=CO2£Øg£©+2H2O£Øl£©”÷H=-890.3kJ•mol-1£¬¼ĘĖć¼×ĶéµÄĪļÖŹµÄĮ棬½įŗĻČČ»Æѧ·½³ĢŹ½¼ĘĖć£»
£Ø2£©ŹµŃéĢ½¾æĪĀ¶Č”¢Ń¹Ēæ¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬¶Ō±ČŹµŃé1”¢3æÉÖŖ£¬¶žÕßĪĀ¶ČĻąµČ£¬ŌņÓ¦ĪŖĢ½¾æŃ¹Ēæ¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬¶Ō±ČŹµŃé2”¢3æÉÖŖ£¬Ö»ÓŠĪĀ¶Č²»Ķ¬£¬ĘäĖüĢõ¼žĻąĶ¬£¬ĖłŅŌŹµŃé2”¢3µÄÄæµÄŹĒĢ½¾æĪĀ¶Č¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£»
Ę½ŗā³£ŹżÖ»ŹÜĪĀ¶ČÓ°Ļģ£¬ĪĀ¶Č²»±ä£¬Ę½ŗā³£Źż²»±ä£¬ČōĪĀ¶ČÉżøߣ¬Ę½ŗāĻņĪüČČ·½ĻņŅĘ¶Æ£¬¼“ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬Ę½ŗā³£ŹżŌö“ó£»
£Ø3£©¼ĘĖć“ĖŹ±ÅضČÉĢQc£¬ÓėĘ½ŗā³£Źż±Č½Ļ£¬ÅŠ¶Ļ·“Ó¦½ųŠŠ·½Ļņ£¬½ų¶ųÅŠ¶Ļv£ØÕż£©”¢v£ØÄę£©µÄĻą¶Ō“󊔹ŲĻµ£®
½ā“š ½ā£ŗ£Ø1£©ŅŃÖŖ£ŗ¢ŁCH4£Øg£©+2O2£Øg£©=CO2£Øg£©+2H2O£Øg£©”÷H=-802.3kJ•mol-1£¬
¢ŚH2O£Ø1£©=H2O£Øg£©”÷H=+44.0kJ•mol-1£¬
øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł-¢Ś”Į2µĆ£¬¼×ĶéĘųĢåĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗCH4£Øg£©+2O2£Øg£©=CO2£Øg£©+2H2O£Øl£©”÷H=-890.3kJ•mol-1£¬
ĖłŅŌ1.6g¼×ĶéĘųĢåµÄĪļÖŹµÄĮæĪŖ$\frac{1.6g}{16g/mol}$=0.1mol£¬¹ŹĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³öČČĮæĪŖ0.1mol”Į890.3kJ•mol-1=89.03kJ£¬
¹Ź“š°øĪŖ£ŗ89.03£»
£Ø2£©Čż×鏵ŃéĢõ¼žŅŖĒóĪĀ¶ČĪŖ360”ę»ņ480”ę”¢Ń¹ĒæĪŖ101kPa»ņ303kPa£¬²ÉČ”æŲÖʱäĮæ·Ø£¬Ģ½¾æĪĀ¶Č”¢Ń¹Ēæ¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬
¶Ō±ČŹµŃé1”¢3æÉÖŖ£¬¶žÕßĪĀ¶ČĻąµČ£¬ŌņÓ¦ĪŖĢ½¾æŃ¹Ēæ¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬¶ųŹµŃé3µÄŃ¹ĒæĪŖ101kPa£¬¹ŹŹµŃé1µÄŃ¹ĒæpĪŖ303kP£¬
¶Ō±ČŹµŃé2”¢3æÉÖŖ£¬¶žÕßŃ¹ĒæĻąµČ£¬ŌņÓ¦ĪŖĢ½¾æĪĀ¶Č¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬¶ųŹµŃé3µÄĪĀ¶ČĪŖ360”ę£¬¹ŹŹµŃé2µÄĪĀ¶ČtĪŖ480”ę£¬
¶Ō±ČŹµŃé2”¢3£¬Ö»ÓŠĪĀ¶Č²»Ķ¬£¬ĘäĖüĢõ¼žĻąĶ¬£¬ĖłŅŌŹµŃé2”¢3µÄÄæµÄŹĒĢ½¾æĪĀ¶Č¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£»
ŹµŃé1”¢3ĪĀ¶ČĻąĶ¬£¬Ę½ŗā³£ŹżĻąĶ¬£¬¼“K1=K3£¬±Č½ĻŹµŃé1”¢2£¬ŹµŃé2ÖŠĪĀ¶Čøߣ¬ĪĀ¶ČÉżøߣ¬Ę½ŗāĻņĪüČČ·½ĻņŅĘ¶Æ£¬øĆ·“Ó¦ĪŖĪüČČ·“Ó¦£¬ĖłŅŌĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬Ę½ŗā³£ŹżŌö“󣬼“K2£¾K1£¬ĖłŅŌK2£¾K1=K3£¬
¹Ź“š°øĪŖ£ŗ480£»303£»Ģ½¾æĪĀ¶Č¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£»K2£¾K1=K3£»
£Ø3£©“ĖŹ±ÅضČÉĢQc=$\frac{2”Į{2}^{3}}{3”Į8.5}$=0.63£¼Ę½ŗā³£ŹżK=1£¬¹Ź·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬¹Źv£ØÕż£©£¾v£ØÄę£©£¬
¹ŹŃ”C£®
µćĘĄ ±¾Ģā漲鷓ӦČČÓŠ¹Ų¼ĘĖć”¢Ó°Ļģ»Æѧ·“Ó¦ĖŁĀŹŅņĖŲµÄĢ½¾æ”¢»ÆŃ§Ę½ŗā³£ŹżµÄÓ°ĻģŅņĖŲÓėÓ¦ÓĆ£¬×¢Ņā»ÆŃ§Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬ÓėĘäĖüĪļĄķĮæĪŽ¹Ų£®


 53ĖęĢĆ²āĻµĮŠ“š°ø
53ĖęĢĆ²āĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Čō¹ÜµĄĀ©ĘųÓö°±»į²śÉś°×ŃĢ | B£® | øĆ·“Ó¦ĄūÓĆĮĖĀČĘųµÄĒæŃõ»ÆŠŌ | ||
| C£® | øĆ·“Ó¦ŹōÓŚø“·Ö½ā·“Ó¦ | D£® | Éś³É1 mol N2ÓŠ6 molµē×Ó×ŖŅĘ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪĀ¶Č/”ę | 10 | 30 | 60 | 90 |
| ÅضČ/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ijŹµŃ銔×éĶ¬Ń§ĪŖĮĖĢ½¾æĶÓėÅØĮņĖįµÄ·“Ó¦£¬½ųŠŠČēĻĀŹµŃ飮
ijŹµŃ銔×éĶ¬Ń§ĪŖĮĖĢ½¾æĶÓėÅØĮņĖįµÄ·“Ó¦£¬½ųŠŠČēĻĀŹµŃ飮| µĪ¼ÓµÄČÜŅŗ | ĀČĖ® | °±Ė® |
| ³ĮµķµÄ»ÆѧŹ½ | BaSO4 | BaSO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
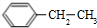 £Øg£©?
£Øg£©?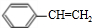 £Øg£©+H2£Øg£©”÷H=a kJ•mol-1£®¾Ņ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā£®·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
£Øg£©+H2£Øg£©”÷H=a kJ•mol-1£®¾Ņ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā£®·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| Ź±¼ä/min | 0 | 10 | 20 | 30 | 40 |
| n£ØŅŅ±½£©/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n£Ø±½ŅŅĻ©£©/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A£® | ·“Ó¦ŌŚĒ°20 minµÄĘ½¾łĖŁĀŹĪŖv£ØH2£©=0.004mol•L-1•min-1 | |
| B£® | ±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ±£¬c£ØŅŅ±½£©=0.08mol•L-1£¬Ōņa£¼0 | |
| C£® | ±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĻņČŻĘ÷ÖŠ³äČė²»²ĪÓė·“Ó¦µÄĖ®ÕōĘų×÷ĪŖĻ”ŹĶ¼Į£¬ŌņŅŅ±½µÄ×Ŗ»ÆĀŹĪŖ50.0% | |
| D£® | ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė0.10molŅŅ±½”¢0.10mol±½ŅŅĻ©ŗĶ0.30molH2£¬“ļµ½Ę½ŗāĒ°v£ØÕż£©£¾v£ØÄę£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
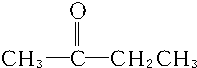 C£ŗCH2ØTCH-CH2CH3»ņCH3CHØTCH-CH3£®
C£ŗCH2ØTCH-CH2CH3»ņCH3CHØTCH-CH3£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | a+8-m-n | B£® | a+16-m-n | C£® | a-8-£Øm+n£© | D£® | a-£Øm+n£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |
| B£® |
| C£® |
| D£® |
|
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com