
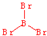
 ;三溴化磷
;三溴化磷 .
. 分析 三溴化硼分子中硼原子的价层电子对数为3+$\frac{3-1×3}{2}$=3,没有孤电子对,所以分子空间构型为平面三角形,三溴化磷分子中磷原子的价层电子对数为3+$\frac{5-1×3}{2}$=4,P原子有一对孤电子对,所以分子空间构型为三角锥形.
解答 解:三溴化硼分子中硼原子的价层电子对数为3+$\frac{3-1×3}{2}$=3,没有孤电子对,所以分子空间构型为平面三角形,结构式为 ,
,
三溴化磷分子中磷原子的价层电子对数为3+$\frac{5-1×3}{2}$=4,P原子有一对孤电子对,所以分子空间构型为三角锥形,结构式为 ,
,
故答案为: ;
; .
.
点评 本题主要考查了分子的空间构型,是高考的热点,应重点掌握,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 将过量二氧化硫通入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
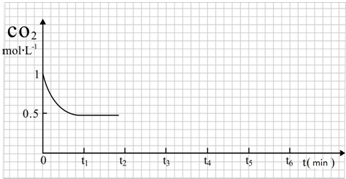
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
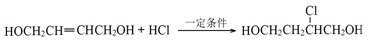 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某实验小组依据反应 AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )
某实验小组依据反应 AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )| A. | pH=0.68时,反应处于平衡状态 | |
| B. | 调节pH可以改变反应的方向 | |
| C. | pH>0.68时,负极电极反应式为2I--2e -═I2 | |
| D. | pH=5时,氧化性I2>AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 不同pH的NaClO2溶液中存在下列关系:c ( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) | |
| D. | 该温度下HClO2的电离平衡常数的数值:Ka≈1.0×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
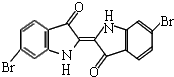 泰雅紫是古代地中海沿岸出产的一种贵重染料,现知其结构为如图所示的含溴有机化合物,下列说法不正确的是( )
泰雅紫是古代地中海沿岸出产的一种贵重染料,现知其结构为如图所示的含溴有机化合物,下列说法不正确的是( )| A. | 泰雅紫分子的分子式为C16H8N2Br2O2 | |
| B. | 1mol泰雅紫与H2加成最多需9molH2 | |
| C. | 泰雅紫属于烃的衍生物 | |
| D. | 检验泰雅紫中溴元素可直接加入硝酸银溶液,观察是否有浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将SO2通入Ba(NO3)2溶液中,溶液变浑浊 | 生成BaSO3沉淀 |
| B | 点燃CO还原Fe2O3后的尾气,气体未能燃烧 | CO已完全反应 |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com