
| A. | 4.4g由CO2和N2O组成的混合气体中的氧原子数为2.2NA | |
| B. | 12g由612C60和614C60组成的固体中的原子数为NA | |
| C. | 常温常压下,22.4LNH3中所含的共价键数为3NA | |
| D. | 1L1mol•L-1次氯酸溶液中的CIO-数为NA |
分析 A.CO2和N2O都含有1个氧原子,摩尔质量相等都是44g/mol;
B.612C和614C相对原子质量不同;
C.常温常压下,Vm大于22.4L/mol,结合1个氨气分子含有3个N-H键解答;
D.次氯酸根离子为弱酸的酸根离子,水溶液中部分水解.
解答 解:A..CO2和N2O都含有1个氧原子,4.4g由CO2和N2O组成的混合气体物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,含有氧原子个数为NA,故A正确;
B.612C和614C相对原子质量不同,所以只知道612C60和614C60组成的固体质量无法计算所含碳原子数目,故B错误;
C.常温常压下,Vm大于22.4L/mol,22.4LNH3物质的量小于1mol,所含的共价键数小于3NA,故C错误;
D.次氯酸根离子为弱酸的酸根离子,水溶液中部分水解,所以1L1mol•L-1次氯酸溶液中的CIO-数小于NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,侧重考查物质所含微粒数目的计算,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积使用条件和对象是解题关键,题目难度不大,注意盐类水解的性质.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:填空题
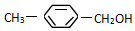 类别醇类或芳香醇.官能团的结构简式-OH名称羟基.
类别醇类或芳香醇.官能团的结构简式-OH名称羟基.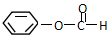 类别酯类.官能团的结构简式-COOC-名称酯基.
类别酯类.官能团的结构简式-COOC-名称酯基.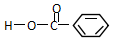 类别羧酸或芳香酸.官能团的结构简式-COOH名称羧基.
类别羧酸或芳香酸.官能团的结构简式-COOH名称羧基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| Ⅰ | 25 | 5 | 0.2 | 10 | 0.1 | x |
| Ⅱ | 25 | 10 | 0.1 | 10 | 0.2 | 5 |
| Ⅲ | 35 | 10 | 0.1 | 5 | y | 10 |
| A. | 该反应所需的仪器有:量筒、温度计、秒表、烧杯 | |
| B. | 通过记录产生淡黄色沉淀所需的时间可以比较反应的快慢 | |
| C. | 比实验 II、III研究温度对该反应速率的影响,则y=0.2 | |
| D. | 对比实验 I、II研究C(H+)对该反应速率的影响,则x=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5molC3H8分子中所含C-H共价键数为2NA | |
| C. | 标准状况下,22.4L乙醇完全燃烧所消耗的氧气分子数为3NA | |
| D. | 1molCH5+离子所含的电子数为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 试剂 | 成分 | 价格/(元•吨-1) |
| 漂液 | 含25.2% NaClO | 450 |
| 双氧水 | 含30% H2O2 | 2400 |
| 浓硝酸 | 含98% HNO3 | 1500 |
| 氢氧化物 | 开始沉淀的pH | 沉淀完全的pH |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.0 | 6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| B. | 最高价氧化物对应水化物的碱性:Z<M | |
| C. | 气态氢化物的稳定性:R>Q | |
| D. | 简单离子的半径:X>Z>M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | FeS | MnS | HgS |
| 溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com