
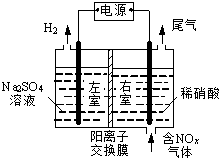
 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).分析 (1)①根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸;
②n(NO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阳极反应式为NO2-e-+H2O=NO3-+2H+,有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室;故答案为:0.1;
(2)①浓硝酸的物质的量浓度=$\frac{1000ρw}{M}$=$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算;
②n(H2)=$\frac{28L}{22.4L/mol}$=1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,
电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成,
根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 mol•L-1×10 L+0.1 mol=1.1 mol,
生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol,
设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒计算.
解答 解:(1)①根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸;
②n(NO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阳极反应式为NO2-e-+H2O=NO3-+2H+,有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室;故答案为:0.1;
(2)①浓硝酸的物质的量浓度=$\frac{1000ρw}{M}$=$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算;
②n(H2)=$\frac{28L}{22.4L/mol}$=1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,
电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成,
根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 mol•L-1×10 L+0.1 mol=1.1 mol,
生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol,
设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒计算.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,明确各个电极上发生的反应及反应中存在的守恒是解本题关键,注意(2)②中电解后的硝酸还包含原来的硝酸,为易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| C. | ②⑤形成的化合物阴阳离子个数比可能为1:1 | |
| D. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在棕色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液保存在带玻璃塞的试剂瓶中 | |
| D. | 新制的氯水通常避光保存在棕色玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
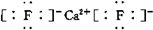 ;若 XY2其结构式为:S=C=S.为共价化合物时,
;若 XY2其结构式为:S=C=S.为共价化合物时,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 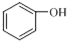 和 和 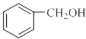 互为同系物 互为同系物 | |
| B. | 乙烷气体中混有乙烯,通入氢气,使乙烯发生加成反应 | |
| C. | 某烃的结构用键线式表示为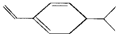 ,该烃与Br2按物质的量之比1:1加成时产物有5种 ,该烃与Br2按物质的量之比1:1加成时产物有5种 | |
| D. | 煤经气化和液化两个物理变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和氯气在光照条件下反应制取氯乙烷 | |
| B. | 2-溴丁烷在氢氧化钠的醇溶液中加热制1-丁烯 | |
| C. | 1,3-丁二烯和溴水加成制取1,2-二溴丁烷 | |
| D. | 乙烯和氯化氢加成制取氯乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com