
A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO
| ||
| B、BaCO3和盐酸:BaCO3+2H+=Ba2++CO2↑+H2O | ||
| C、铜与盐酸反应:Cu+2H+=Cu2++H2↑ | ||
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.5NA个戊烷分子所占的体积为11.2L |
| B、常温常压下,17g氨气所含电子数为10NA |
| C、2.24L氮气所含的原子数为0.2NA |
| D、NA个氧分子的质量为16g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤ | B、①②④⑥ |
| C、②③④⑥ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用防腐剂延长食品保质期 |
| B、利用风力发电,获取清洁能源 |
| C、研发可降解塑料,控制白色污染 |
| D、将汽车尾气中的NO和CO转化为无害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
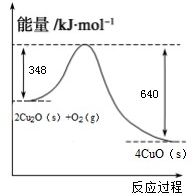 科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
| ||
| Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| SO3 | 0mol | 4mol | 2mol | 0mol |
| SO2 | 4mol | 1.5mol | 0mol | 4mol |
| O2 | 2mol | 0mol | 0mol | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3?H2O | ||||
B、铜片接电源正极,碳棒接电源负极,电解硫酸溶液Cu+2H+
| ||||
| C、磷酸一氢钠溶液水解:HPO42-+H2O═PO43-+H3O+ | ||||
| D、漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com