
【题目】吸食或注射毒品会危及人体健康。下列各组物质中都属于毒品的是
A.冰毒、黄连素B.味精、麻黄碱
C.纤维素、尼古丁D.海洛因、冰毒
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
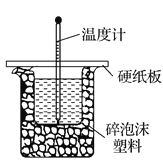
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组专门研究了氧族元素及其某些化合物的部分性质。所查资料信息如下:
①酸性:H2SO4>H2SeO4>H2TeO4
②氧、硫、硒与氢气化合越来越难,碲与氢气不能直接化合
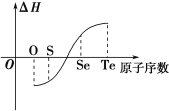
③由元素的单质生成等物质的量的氢化物的焓变情况如上图所示:
请完成下列问题:
(1)H2与硫化合的反应______热量(填“放出”或“吸收”)。
(2)已知H2Te分解反应的ΔS>0,请解释为什么Te和H2不能直接化合_________________________________________。
(3)上述资料信息中能够说明硫元素非金属性强于硒元素的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下KMnO4氧化浓HCl的反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目
(2)又已知MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
(3)浓盐酸在反应中显示出来的性质是 (填编号)
A只有还原性 B还原性和酸性 C只有氧化性 D氧化性和酸性
(4)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某含碳、氢、氧三种元素的有机物,其碳、氢、氧的质量比为6:1:8,它的实验式为__________;该有机物蒸气的密度是相同条件下氢气密度的30倍,则该有机物的分子式为____。
(2)据报道,2002年10月26日俄罗斯特种部队在解救人质时,使用了一种麻醉作用比吗啡强100倍的氟烷,已知氟烷的化学式为C2HClBrF3,则沸点不同的上述氟烷有_____(写出结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 24gNaH中阴离子所含电子总数为2NA
B. 标准状况下,44.8LNO与22.4LO2充分混合后,气体中分子总数为2NA
C. 在0.lmol/L的K2CO3溶液中,因CO32-的水解,阴离子数目大于0.1NA
D. 300mL 2mol/L乙醇溶液中所含分子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填下列装置的序号: 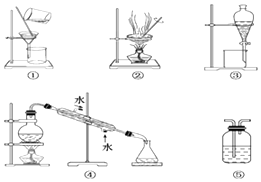
(1)分离Na2CO3溶液和CH3COOC2H5(难溶于水的液体),选 , 操作名称为 .
(2)用CCl4提取碘水中的碘,选 , 操作名称为 .
(3)用氢氧化钠溶液吸收CO2 , 选 , 操作名称为 .
(4)用自来水制取纯净水,选 , 操作名称为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)![]() 5N2(g) + 6H2O(l)
5N2(g) + 6H2O(l) ![]()
反应②:2NO(g) + O2(g) ![]() 2NO2(g)
2NO2(g) ![]() (
( ![]() < 0且
< 0且![]() =2
=2![]() )
)
反应③:4NH3(g) + 6NO2(g)![]() 5N2(g)+ 3O2 + 6H2O(l)
5N2(g)+ 3O2 + 6H2O(l) ![]()
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
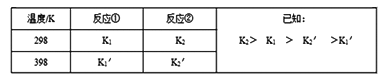
(1)试推测反应③是______ 反应(填“吸热”或“放热”)。
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。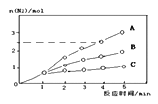
则:①计算0~4min时在A催化剂作用下,反应速率v(NO)=_______________
②下列说法正确的是:________________________
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO 和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_________(填“是”或“不是”已知该温度下该反应的K约为147.3).达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和1.5mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是( )

A. 甲为C,X是O2 B. 甲为SO2,X是NaOH溶液
C. 甲为Cl2,X为Fe D. 甲为Al,X为NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com