
| A、已知2H2(gO2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 |


科目:高中化学 来源: 题型:
| A、[NO3-]>[OH-]>[NH4+]>[Ba2+] |
| B、[NO3-]>[Ba2+]>[OH-]>[NH4+] |
| C、[Ba2+]>[NO3-]>[OH-]>[NH4+] |
| D、[NO3-]>[Ba2+]>[NH4+]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、均不变 |
| B、均增大 |
| C、①增大,②不变,③减少 |
| D、①减少,②不变,③增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,将1 g铝片投入20 mL 18.4 mol?L-1的硫酸中 |
| B、向100 mL 3 moI?L-1的硝酸中加入5.6 g铁 |
| C、用50 mL 18 mol?L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗) |
| D、在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在室内放置一些特别的绿色植物,可用于室内空气的净化 |
| B、合金的熔点一般高于各组成成分金属的熔点 |
| C、氢氧化钠溶液用盖橡胶塞的试剂瓶盛装 |
| D、工业上用盐酸刻蚀玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 模拟海水中的离 子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
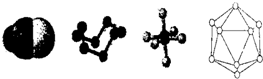
| A、已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B-B键、12个硼原子 |
| B、SF6为正八面体的非极性分子 |
| C、1 molHCN分子中有2 molσ键和2molπ键 |
| D、32gS8分子中含有0.125 molσ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |


| 实验次数 | 初始温度t1/℃ | 混合液最高温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 19.9 | 20.0 | 23.2 |
| 2 | 20.0 | 20.1 | 23.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com