
| A. | ②④ | B. | ①④ | C. | ②③ | D. | ①③ |
分析 经2s后测得C的浓度为0.3mol/L,则
2A(g)+B(g)?2C(g)
开始 1 0.5 0
转化 0.3 0.15 0.3
2s 0.7 0.35 0.3
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:经2s后测得C的浓度为0.3mol/L,则
2A(g)+B(g)?2C(g)
开始 1 0.5 0
转化 0.3 0.15 0.3
2s 0.7 0.35 0.3
①用A表示的平均反应速率为$\frac{0.3mol/L}{2s}$=0.15mol/(L•s),故错误;
②由上述分析可知,2s时物质A的浓度为$\frac{3mol}{3L}$-0.3mol/L=0.7mol/L,故正确;
③用B表示的平均反应速率为$\frac{0.15mol/L}{2s}$=0.075mol/(L•s),故错误;
④2s时物质B的转化率为$\frac{0.15}{0.5}$×100%=30%,故正确;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率及转化率计算为解答的关键,侧重分析与计算能力的考查,注意容器的体积,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 | |
| B. | 随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 | |
| C. | 在化学反应中,原子首先失去的电子能量最低 | |
| D. | 在元素周期表中,各主族元素的最高化合价与其族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 四种毒品中都含有苯环,都属于芳香烃 | |
| B. | 摇头丸经消去、加成反应可制得冰毒 | |
| C. | 1mol大麻与溴水反应最多消耗3mol Br2 | |
| D. | 氯胺酮分子中环上所有碳原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石-石膏法可用于燃煤的脱硫 | |
| B. | 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 | |
| C. | 焦炭在炼铁高炉中用于提供热能和产生还原性气体CO | |
| D. | 氢氧化铁胶体可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 石油裂解可得烃D,其产量是一个国家石油化工发展水平的标志,已知D在标准状况下的密度为1.25g•Lˉ1.有机物B可利用植物秸秆来生产,E为有香味的油状液体,它们之间的转化关系如图,请回答:
石油裂解可得烃D,其产量是一个国家石油化工发展水平的标志,已知D在标准状况下的密度为1.25g•Lˉ1.有机物B可利用植物秸秆来生产,E为有香味的油状液体,它们之间的转化关系如图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的结构示意图: | B. | Na的电子排布式:1s22s22p63s1 | ||
| C. | Na+的轨道表示式: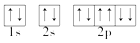 | D. | Na的简化电子排布式:[Ne]3s1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com